E-Labeling und E-Broschüren in der Region APAC
Die Zukunft der Arzneimittelinformationen in ASIEN: eine Branchenperspektive
Die Verfügbarkeit der neuesten Produktinformationen auf öffentlich zugänglichen Websites kann ein wichtiger erster Schritt zur Verbesserung der Patientensicherheit und des Vertrauens in Arzneimittel sein und dazu beitragen, den Transformationsprozess von der Papierkennzeichnung zur E-Kennzeichnung zu beschleunigen. Eine verbesserte Zugänglichkeit auf öffentlichen Websites verbessert das Benutzererlebnis durch eine bessere Navigation durch die Produktinformationen, kann das Verständnis für die korrekte Verwendung von Arzneimitteln erhöhen und im Vergleich zu herkömmlicheren gedruckten Kennzeichnungsmaterialien eine bessere Vertrautheit mit dem Sicherheits- und Wirksamkeitsprofil des Arzneimittels vermitteln.
Die Rolle der Produktinformationen (die „Kennzeichnung“)
Die Produktinformationen (die „Kennzeichnung“) sind ein wichtiger Bestandteil des eingereichten Dossiers, aber auch ein wichtiges Kommunikationsinstrument. Eine Vielzahl von Formaten (Papier, elektronisch) und Typen (Patient, HCP) werden entsprechend den nationalen Anforderungen verteilt. Es ist auch eine wichtige Maßnahme zur Risikominimierung, die Nutzen/Risiko und Gebrauchsanweisungen kommuniziert.
Je nach Land kann die Packung Informationen für medizinisches Fachpersonal (z. B. USA, Japan und Indien) oder Patienteninformationen (z. B. EU) enthalten; in Asien enthalten die meisten kommerziellen Packungen eine Kennzeichnung, die sich an HCPs richtet.
Digital bringt ein Umdenken
Bisher lag der Fokus bei der Kennzeichnung auf der Aushandlung des Inhalts und der Pflege der Produktinformationen nach der Zulassung. Wenig Beachtung wurde der Frage geschenkt, wie das Etikett im wirklichen Leben abgerufen, verwendet, verstanden und eingehalten wird. Mit der Digitalisierung rückt der Fokus nun in Richtung „Kundenerlebnis“.
Was ist E-Labelling?
Wenn wir von E-Labelling sprechen, meinen wir eigentlich eine Liste obligatorischer oder optionaler Implementierungen:
- Verfügbarkeit der neuesten Produktinformationen auf einer öffentlich zugänglichen Website (d. h. Produktinformationen sind online leicht zugänglich).
- Informationen in einem leicht zugänglichen (d. h. durch Scannen eines Codes auf der Verpackung), leser- und smartphonefreundlichen Format (d. h. einem webbasierten Format); die meisten Formate müssen größenveränderbaren Text, mehrere Sprachen und durchsuchbare Inhalte unterstützen.
- Fehlende Papierkennzeichnung auf der Handelspackung.
- Unterstützung für Informationen in strukturierten Inhalten (z. B. FHIR XML)
- Interoperabilität zwischen Systemen (d. h. Austausch von Produktinformationen über Wearables, elektronische Rezepte und elektronische Gesundheitsakten hinweg).
Warum ist es wichtig?
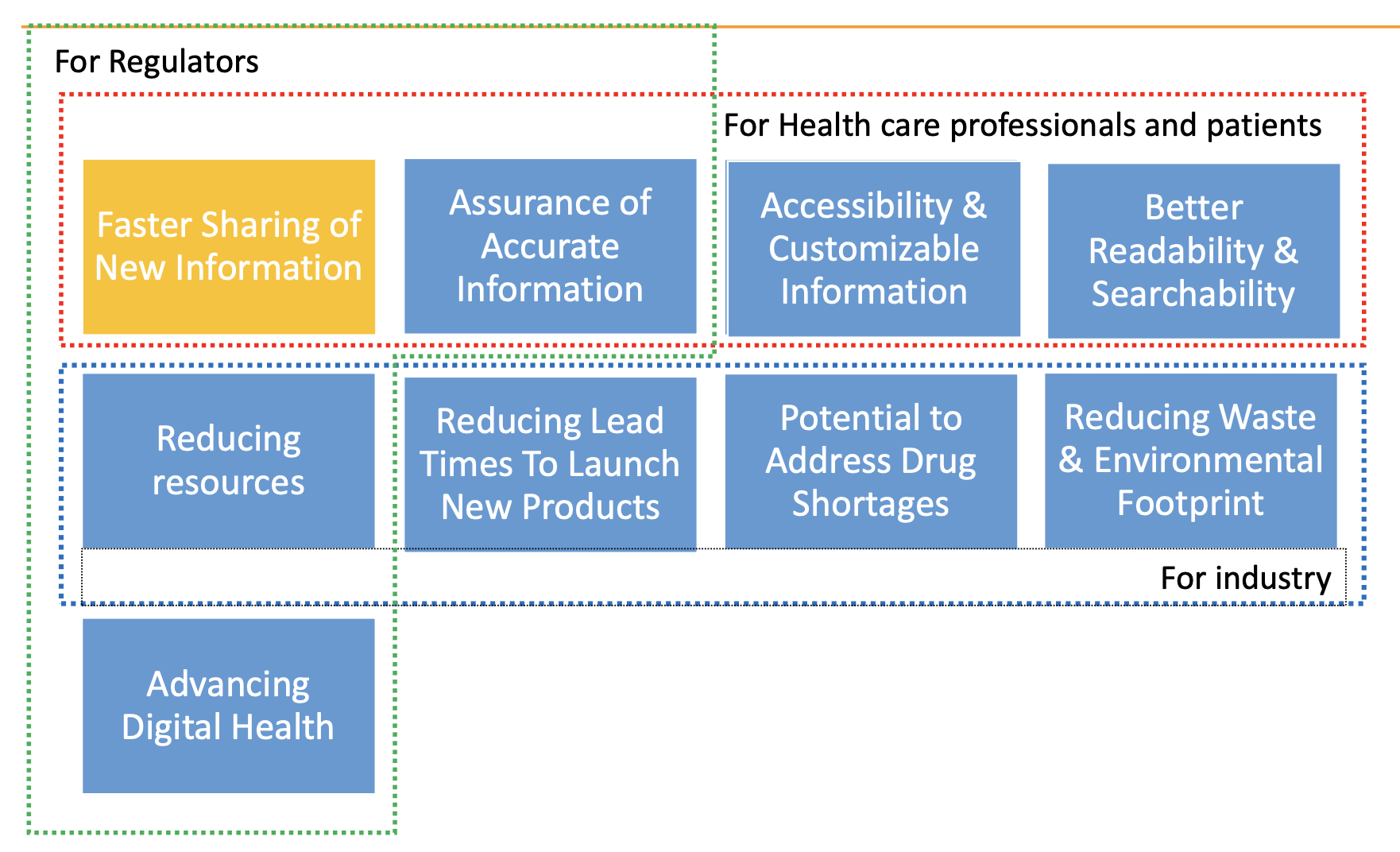
E-Labelling kann Folgendes verbessern:
- Zugänglichkeit und Verständnis der aktuellsten Produktinformationen für Patienten und medizinisches Fachpersonal.
- Einhaltung.
- Patientenergebnisse.
- Prozesseffizienz und Reduzierung von Papiermüll.
Vorteile von E-Labelling
Bedenken:
- Digitale Fähigkeiten: Personen mit unzureichenden digitalen Fähigkeiten, wie z. B. ältere Menschen, haben möglicherweise Schwierigkeiten, auf Produktinformationen in elektronischem Format zuzugreifen.
- Fehlender Internetzugang: In ländlichen Gebieten oder in Notsituationen kann der Internetzugang eingeschränkt oder nicht verfügbar sein.
Die Einführung der elektronischen Kennzeichnung in Japan
- PMDA verlangt seit vielen Jahren SGML-Versionen der JPI (HCP-Kennzeichnung) und hat 2019 mit der Umstellung auf XML begonnen.
- Im Dezember 2019 wurde das „Gesetz über Arzneimittel und Medizinprodukte“ geändert, um die elektronische Kennzeichnung offiziell einzuführen. Damit wird die Papierkennzeichnung ersetzt und das erforderliche Begleitsystem bereitgestellt, das allen Angehörigen der Gesundheitsberufe Zugriff auf die aktuellen Kennzeichnungsinformationen ermöglicht.
- Der GS1-Barcode muss auf die äußere Verpackung gedruckt werden, damit Angehörige der Gesundheitsberufe auf die Kennzeichnungsinformationen zugreifen können. Ab Mai 2021 ist eine mobile App zum Lesen von GS1-Barcodes verfügbar.
- Die Durchsetzung der Änderung des „Arzneimittel- und Medizinproduktegesetzes“ wurde am 1. August 2021 umgesetzt.
- Nach einer zweijährigen Übergangszeit wurde die Anforderung der Papierkennzeichnung Ende Juli 2023 aufgehoben.
Print-on-Demand und Zugang zu Papierbroschüren
Der Inhaber der Zulassung (in Zusammenarbeit mit einem Großhändler, falls erforderlich) muss auf Anfrage eine Papierkopie der Produktbroschüre bereitstellen, insbesondere ist er verpflichtet:
- Bei der Erstlieferung der Produkte Packungsbeilagen in Papierform an medizinische Einrichtungen und Apotheken bereitzustellen.
- Medizinische Einrichtungen und Apotheken rechtzeitig überarbeitete Informationen in Papierform bereitzustellen.
Fall Japan: Branchenanforderungen für eine E-Labelling-Implementierung
Die wichtigsten Aufgaben, die Unternehmen für eine E-Labelling-Implementierung erfüllen müssen, sind:
- Etiketten auf die PMDA-Website hochzuladen.
- Vervollständigen Sie die Verknüpfung zwischen dem GS1-Code und den Kennzeichnungsinformationen.
- Richten Sie den Prozess ein, der die Aktualisierung der SOP zur Implementierung der elektronischen Kennzeichnung umfasst.
- Schulen Sie HCPs in der Verwendung der elektronischen Kennzeichnung (App- und Webnutzung).
Verpackungsauswirkungsbewertung für die elektronische Kennzeichnung
Die Rollen der Verpackung:
Schutz und Erhaltung von Produkten Kanäle während des Transports, der Lagerung und des Vertriebs von der ersten Eindämmung bis zum Ende des Produktverbrauchs.
Wichtige Rollen des Beipackzettels:
- Er ist ein greifbarer funktionaler Bestandteil der Verpackung.
- Er trägt zur Stabilität des Produkts im Behälter während des Transports bei.
- Er kann ein gewisses Maß an Lichtschutz und Wärmeisolierung bieten.
Vor jeder Implementierung von E-Labeling ist eine Verpackungsrisikobewertung ein MUSS.
Japan: Methoden zum Durchsuchen der neuesten Beipackzettelinformationen
Im Jahr 2022 führten das MHLW und die PMDA eine Umfrage durch, die sich unter anderem auf die Auswirkungen der Digitalisierung von Beipackzetteln konzentrierte. Die wichtigsten Ergebnisse dieser Umfrage sind:
- 75,6 % der Krankenhäuser und 48,1 % der Apotheken besuchen die PMDA-Website, um die neuesten Beipackzettelinformationen einzusehen.
- 47,9 % bzw. 55,0 % der befragten Einrichtungen verwenden ihr internes System wie das elektronische Krankenaktensystem und das Quittungscomputersystem.
- 75,2 % der Krankenhäuser und 71,4 % der Apotheken verwenden auch Beipackzettel aus Papier
- Nur 1,7 % der Krankenhäuser und 2,7 % der Apotheken verlassen sich ausschließlich auf Beipackzettel aus Papier
Ausblick auf E-Labelling-Initiativen auf den asiatischen Märkten
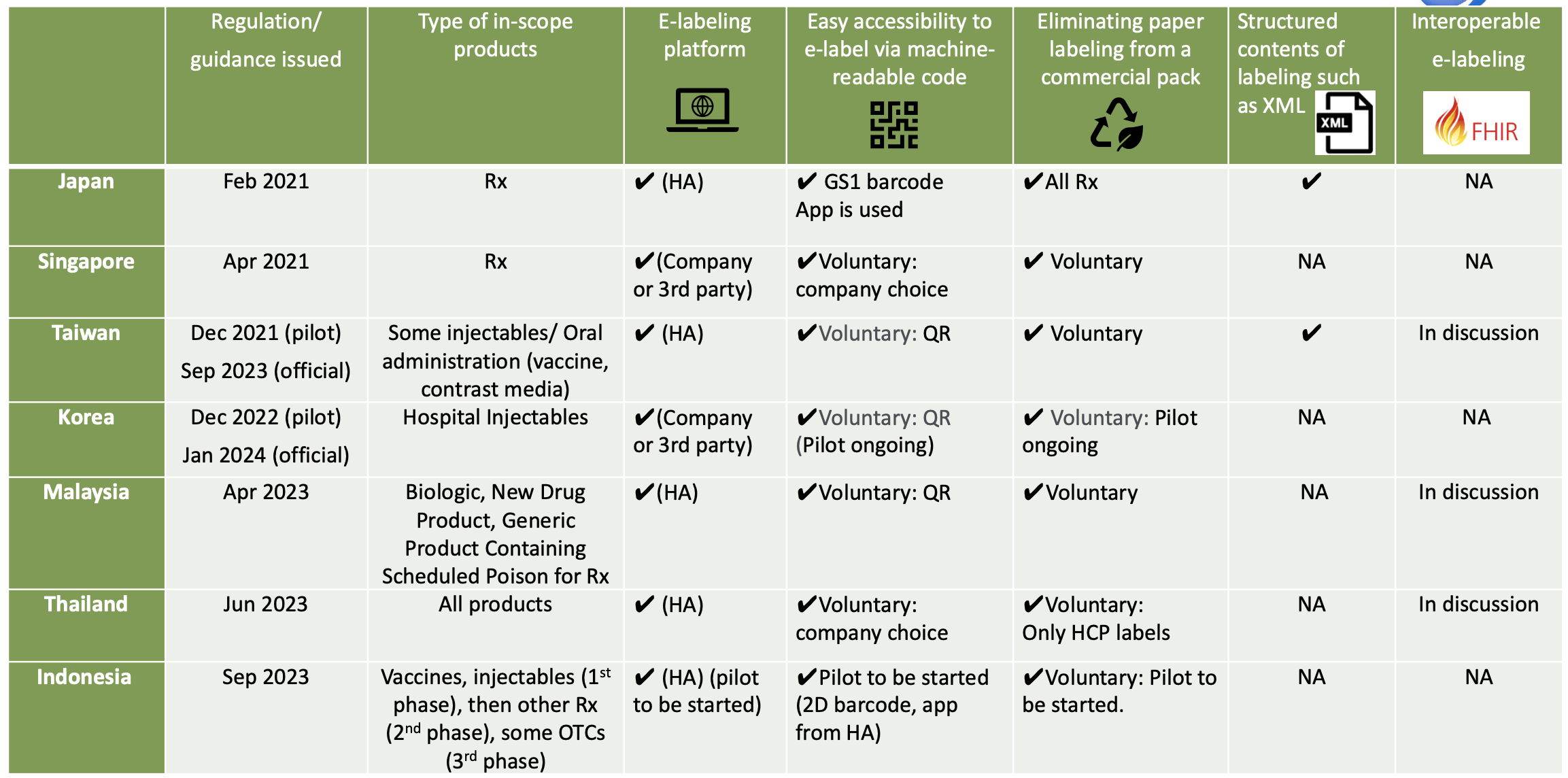
E-Labelling-Initiativen in Asien
In Thailand hat die thailändische FDA offiziell angekündigt, dass E-Labelling seit dem 23. Juni 2023 für Neuregistrierungen per E-Submission vollständig implementiert ist. Die Implementierung von E-Labelling ist für Neuregistrierungsanträge, die nach dem angekündigten Datum eingereicht werden, obligatorisch. Auf dem Produktkarton sollte ein Zugangscode wie ein QR-Code angegeben sein. Sobald der Zugangscode gescannt wurde, sind die Produktinformationen für HCPs und Patienten als PDF-Dateien auf der Website der thailändischen FDA verfügbar. Aufgrund der Einführung der elektronischen Kennzeichnung kann auf Papierkennzeichnung für medizinisches Fachpersonal verzichtet werden, für die physische Kennzeichnung ist jedoch eine Packungsbeilage erforderlich.
In Singapur hat HSA die Kennzeichnung von medizinischem Fachpersonal und Patienten auf seiner Website veröffentlicht, diese Website wird jedoch nicht im Zusammenhang mit der Pilotstudie zur elektronischen Kennzeichnung verwendet. Die endgültige Anleitung zur elektronischen Kennzeichnung von therapeutischen Produkten* wurde veröffentlicht und ist am 30. April 2021 in Kraft getreten. Die Einführung der elektronischen Kennzeichnung ist für Unternehmen freiwillig, wenn keine physischen Etiketten mit der Packung verteilt werden müssen. Einige Unternehmen haben Pilotstudien zur elektronischen Kennzeichnung mit QR-Codes und Datamatrix-Codes begonnen, die die Packung mit dem PI verknüpfen.
In Malaysia werden sowohl die Kennzeichnung von medizinischem Fachpersonal als auch die Kennzeichnung von Patienten auf der Website der Malaysia HA (NPRA) veröffentlicht. Die NPRA hat im April 2023 die Leitlinie zur elektronischen Kennzeichnung (e-Labelling) für pharmazeutische Produkte herausgegeben, die am 1. Mai 2023 in Kraft getreten ist. Unter E-Labelling versteht man die Bereitstellung genehmigter Produktinformationen, die den Beipackzettel (PI) und/oder die Arzneimittelinformationsbroschüre (RiMUP) umfassen, elektronisch über einen maschinenlesbaren Quick Response (QR)-Code auf der Außenverpackung/dem Innenetikett des Produkts, der mit dem NPRA QUEST-System verknüpft ist.
In Indonesien hat BPOM am 14. September 2023 die Leitlinien zur Umsetzung des Pilotprojekts zur elektronischen Kennzeichnung herausgegeben. Im Rahmen des Pilotprojekts wird die elektronische Kennzeichnung auf der BPOM-Website über einen Serialisierungs-Barcode (QR oder GS1-Datenmatrix) verfügbar sein. Die mobile App von BPOM wird ebenfalls für die elektronische Kennzeichnung verwendet. In Indonesien wurde die GS1-Datenmatrix zur Serialisierung einiger Produkte implementiert, für die BPOM bereits eine mobile App entwickelt hat und die die Funktion der elektronischen Kennzeichnung hinzufügen wird. Papieretiketten können entfernt werden. Das Pilotprojekt wird 2 Jahre dauern.
Nächste Schritte
Die Bereitstellung von Kennzeichnungsinformationen als .doc- (Word-) oder .pdf-Datei ist restriktiv, da es sich dabei um „unstrukturierte“ Formate handelt. Diese Dateien können nicht „digital“ verwendet werden und ermöglichen nicht die vollständige Nutzung der Möglichkeiten, die sich durch die Umstellung auf ein webfreundlicheres Format ergeben.
Die Umstellung auf ein „strukturiertes Format“ wie eLeaflet oder HL7FHIR bietet eine Reihe von Vorteilen:
- Möglichkeit zur weiteren digitalen Transformation
- Link zu elektronischen Gesundheitsakten
- Erstellung maßgeschneiderter (personalisierter) Etiketten
- Automatisierte Erstellung anderer Materialien
- Bereitstellung von Nachweisen aus der Praxis