Etiquetado electrónico y prospectos electrónicos en la región APAC
El futuro de la información sobre medicamentos en Asia y el Pacífico: una perspectiva de la industria
Etiquetado electrónico y prospectos electrónicos en la región APAC El futuro de la información sobre medicamentos en Asia y el Pacífico: una perspectiva de la industria
La disponibilidad de la información más reciente sobre los productos en sitios web de acceso público puede ser un primer paso importante para mejorar la seguridad y la confianza de los pacientes en los medicamentos y puede ayudar a acelerar el proceso de transformación del etiquetado en papel al etiquetado electrónico. Una mejor accesibilidad en los sitios web públicos mejora la experiencia del usuario al mejorar la navegación por la información sobre los productos, puede aumentar la comprensión del uso correcto de los medicamentos y proporciona una mejor familiaridad con el perfil de seguridad y eficacia del medicamento en comparación con los materiales de etiquetado impresos más convencionales.
El papel de la información del producto (el “etiquetado”)
La información del producto (el “etiquetado”) es un componente clave del expediente presentado, pero también una herramienta de comunicación crucial. Se distribuyen diversos formatos (papel, electrónico) y tipos (paciente, profesional sanitario) según los requisitos nacionales. También es una medida crítica de minimización de riesgos que comunica los beneficios/riesgos y las instrucciones de uso.
Dependiendo del país, el envase puede contener información para profesionales sanitarios (p. ej., EE. UU., Japón e India) o información para pacientes (p. ej., UE); en Asia, la mayoría de los envases comerciales contienen etiquetas dirigidas a profesionales sanitarios.
La tecnología digital trae un cambio de mentalidad
Hasta ahora, gran parte de la atención en materia de etiquetado se ha centrado en la negociación del contenido y el mantenimiento de la información del producto después de la aprobación. Se ha prestado poca atención a cómo se accede a la etiqueta, cómo se la utiliza, cómo se la entiende y cómo se la respeta en la vida real. Con la tecnología digital, el enfoque se está desplazando hacia la “experiencia del cliente”.
¿Qué es el etiquetado electrónico?
Cuando nos referimos al etiquetado electrónico, en realidad nos referimos a una lista de implementaciones obligatorias u opcionales:
- Disponibilidad de la información más reciente sobre el producto en un sitio web de acceso público (es decir, la información del producto es fácilmente accesible en línea).
- Información disponible en un formato de fácil acceso (es decir, escaneando un código en el paquete), apto para lectores y teléfonos inteligentes (es decir, un formato basado en la web); la mayoría de los formatos deben admitir texto redimensionable, varios idiomas y contenido que se pueda buscar.
- Falta de etiquetado en papel en el paquete comercial.
- Compatibilidad con información en contenido estructurado (p. ej., FHIR XML)
- Interoperabilidad entre sistemas (es decir, intercambio de información de productos entre dispositivos portátiles, recetas electrónicas y registros de salud electrónicos).
¿Por qué es importante?
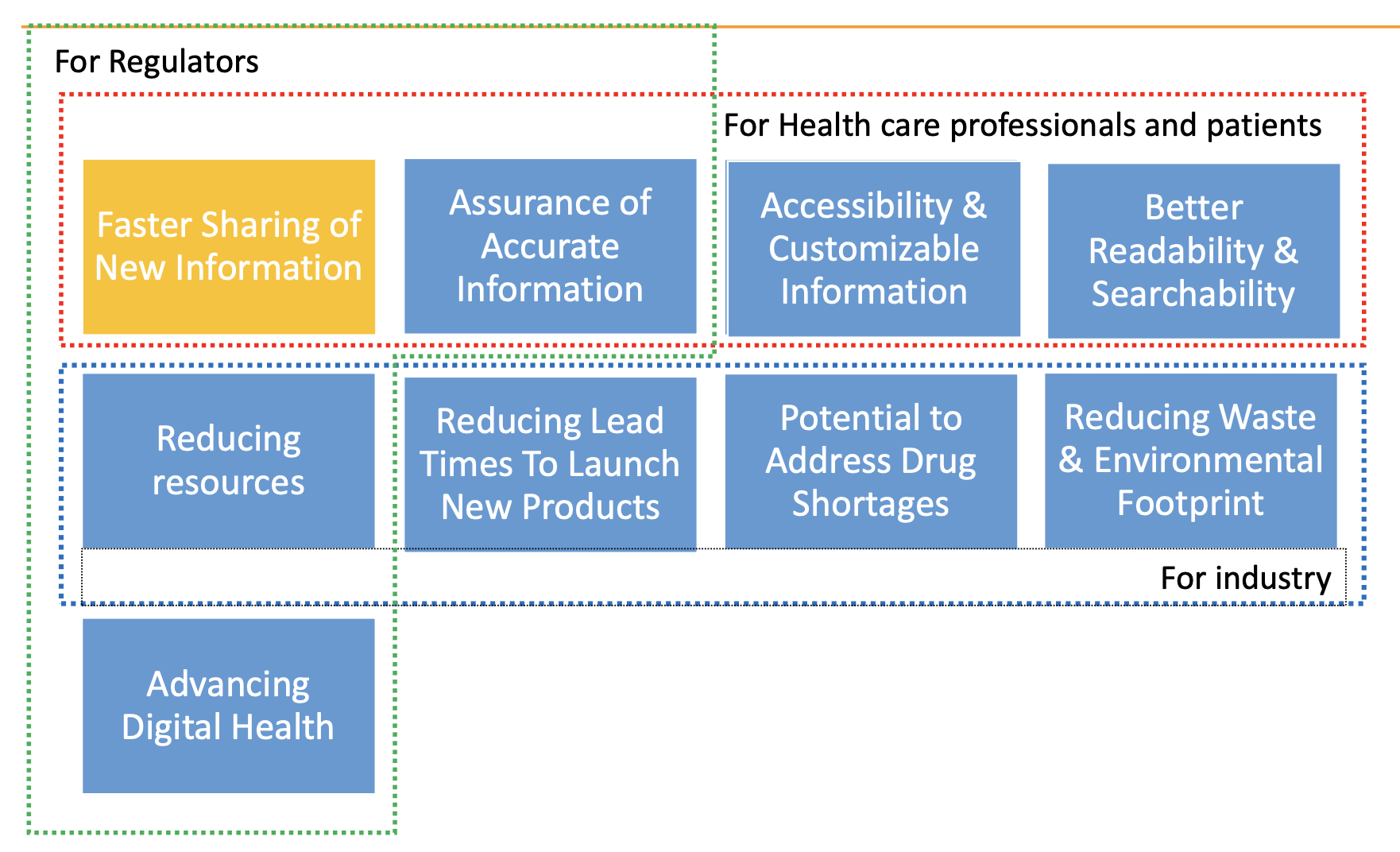
El etiquetado electrónico puede mejorar:
- Accesibilidad y comprensión de la información más reciente sobre productos para pacientes y profesionales sanitarios.
- Adherencia.
- Resultados para los pacientes.
- Eficiencia de los procesos y reducción del desperdicio de papel.
Beneficios del etiquetado electrónico
Inquietudes:
- Habilidades digitales: las personas con habilidades digitales insuficientes, como las personas mayores, pueden tener dificultades para acceder a la información de los productos en formato electrónico.
- Falta de acceso a Internet: en áreas rurales o en situaciones de emergencia, el acceso a Internet puede ser limitado o no estar disponible.
Implementación del etiquetado electrónico en Japón
- La PMDA ha requerido versiones SGML del JPI (etiquetado para profesionales sanitarios) durante muchos años y ha comenzado a cambiar a XML en 2019.
- En diciembre de 2019, se modificó la "Ley de productos farmacéuticos y dispositivos médicos" para introducir oficialmente el etiquetado electrónico, reemplazando el etiquetado en papel y acompañando el esquema necesario que permite a todos los profesionales sanitarios acceder a la información de etiquetado actualizada.
- El código de barras GS1 debe imprimirse en la caja exterior para que los profesionales sanitarios puedan acceder a la información de etiquetado. Una aplicación móvil para leer códigos de barras GS1 estuvo disponible a partir de mayo de 2021.
- La aplicación de la enmienda de la "Ley de Productos Farmacéuticos y Dispositivos Médicos" se implementó el 1 de agosto de 2021.
- Después de un período de transición de 2 años, el requisito de etiquetado en papel se eliminó a fines de julio de 2023.
Impresión bajo demanda y acceso a folletos en papel
El titular de la autorización de comercialización (en cooperación con un mayorista, si es necesario) debe proporcionar una copia en papel del folleto del producto cuando se lo soliciten, específicamente debe:
- Proporcionar prospectos en formato papel a las instituciones médicas y farmacias en la entrega inicial de los productos.
- Proporcionar información revisada en formato papel a las instituciones médicas y farmacias de manera oportuna.
Caso de Japón: requisitos de la industria para una implementación de etiquetado electrónico
Las principales tareas que las empresas deben implementar para una implementación de etiquetado electrónico son:
- Cargar etiquetas en el sitio web de la PMDA.
- Completar el vínculo entre el código GS1 y la información de etiquetado.
- Establecer el proceso que incluye la actualización de los procedimientos operativos estándar para implementar el etiquetado electrónico.
- Educar a los profesionales sanitarios sobre cómo utilizar el etiquetado electrónico (aplicación y uso web).
Evaluación del impacto del embalaje para el etiquetado electrónico
Las funciones del embalaje:
Proteger y preservar los productos Conductos durante el transporte, almacenamiento y distribución desde el confinamiento inicial hasta el final del consumo del producto.
Funciones fundamentales del prospecto:
- Es un componente funcional tangible del embalaje.
- Ayuda a la estabilidad del producto en el contenedor durante el transporte.
- Puede proporcionar ciertos grados de protección contra la luz y aislamiento térmico.
Una evaluación de riesgos del embalaje es OBLIGATORIA antes de cualquier implementación de etiquetado electrónico.
Japón: métodos para buscar la información más reciente del prospecto
En 2022, el MHLW y la PMDA llevaron a cabo una encuesta centrada, entre otros, en el impacto de la digitalización de los prospectos; los principales resultados de esta encuesta son:
- El 75,6 % de los hospitales y el 48,1 % de las farmacias visitan el sitio web de la PMDA para ver la información más reciente del prospecto.
- El 47,9 % y el 55,0 %, respectivamente, de las instalaciones encuestadas utilizan su sistema interno, como el sistema de registro médico electrónico y el sistema informático de recibos. * El 75,2 % de los hospitales y el 71,4 % de las farmacias también utilizan prospectos en papel
- Solo el 1,7 % de los hospitales y el 2,7 % de las farmacias utilizan únicamente prospectos en papel
Perspectivas de las iniciativas de etiquetado electrónico en los mercados asiáticos
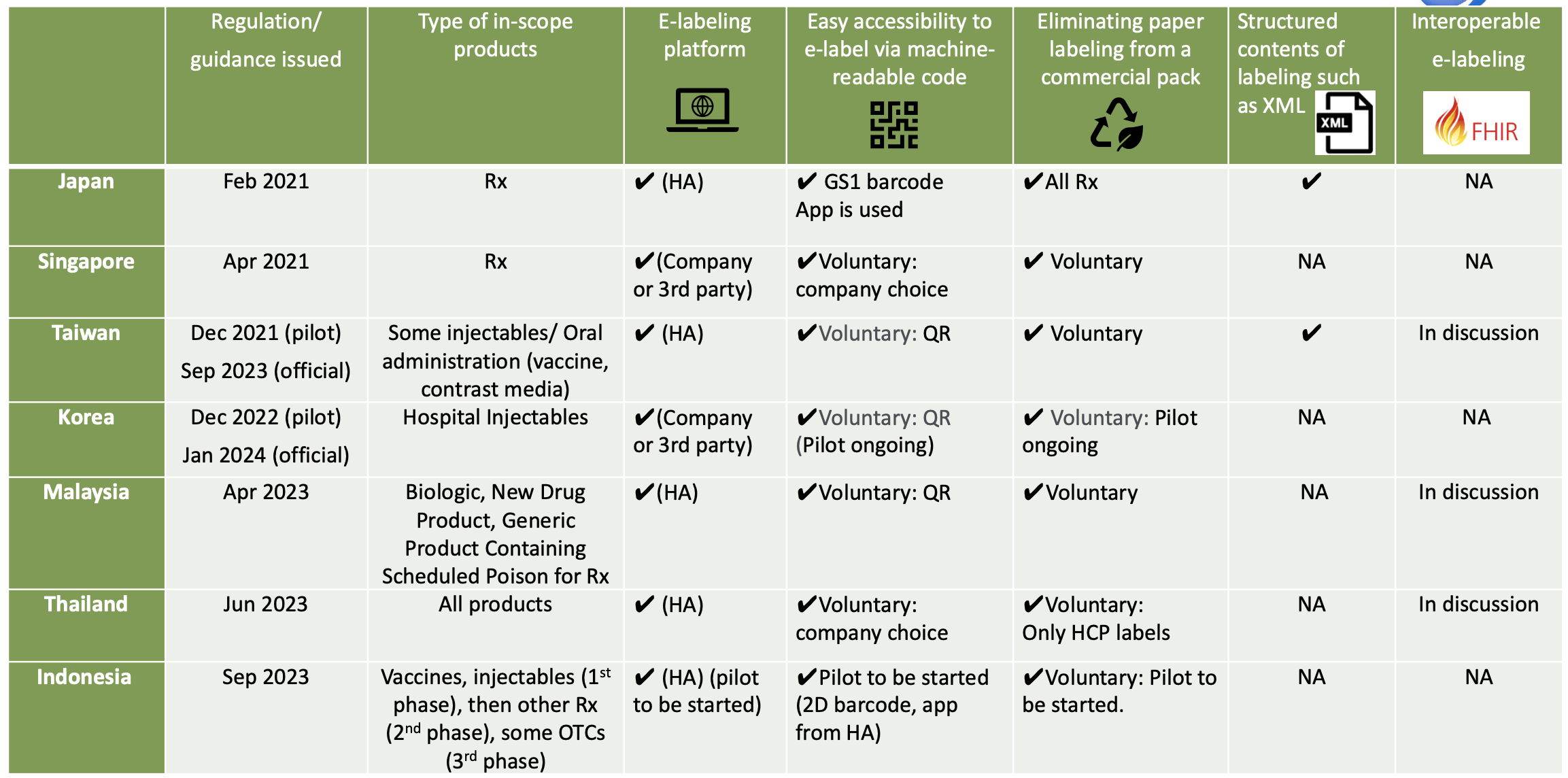
Iniciativas de etiquetado electrónico en Asia
En Tailandia, la FDA tailandesa ha anunciado oficialmente que el etiquetado electrónico se ha implementado por completo para los nuevos registros mediante presentación electrónica desde el 23 de junio de 2023. La implementación del etiquetado electrónico es obligatoria para las nuevas solicitudes de registro presentadas después de la fecha anunciada. El código de accesibilidad, como el código QR, debe indicarse en la caja del producto. Una vez escaneado el código de accesibilidad, la información del producto para profesionales sanitarios y pacientes está disponible como archivos PDF en el sitio web de la FDA tailandesa. El etiquetado en papel para profesionales sanitarios puede eliminarse gracias a la implementación del etiquetado electrónico, pero se requiere PIL para el etiquetado físico.
En Singapur, la HSA publicó el etiquetado para profesionales sanitarios y pacientes en su sitio web, pero su sitio web no se utiliza en relación con el estudio piloto de etiquetado electrónico. Se ha publicado la guía final sobre el etiquetado electrónico de productos terapéuticos* y ha entrado en vigor a partir del 30 de abril de 2021. Es voluntario que las empresas implementen el etiquetado electrónico cuando no sea necesario distribuir etiquetas físicas con el paquete. Algunas empresas han iniciado estudios piloto de etiquetado electrónico utilizando códigos QR y códigos Data Matrix que vinculan el paquete con el IP.
En Malasia, tanto el etiquetado para profesionales sanitarios como para pacientes se publican en el sitio web de la Autoridad de Salud de Malasia (NPRA). La NPRA publicó la Guía sobre etiquetado electrónico (e-Labeling) para productos farmacéuticos en abril de 2023 y entró en vigencia el 1 de mayo de 2023. El etiquetado electrónico se define como la provisión de información aprobada sobre un producto que incluye el prospecto (PI) y/o el prospecto de información sobre medicamentos para el consumidor (RiMUP) de forma electrónica a través de un código de respuesta rápida (QR) legible por máquina en la caja exterior/etiqueta interior del producto que se vincula al sistema NPRA QUEST.
En Indonesia, BPOM publicó la Guía sobre la implementación del proyecto piloto de etiquetado electrónico el 14 de septiembre de 2023. En el proyecto piloto, el etiquetado electrónico estará disponible en el sitio web de BPOM a través de un código de barras serializado (QR o matriz de datos GS1). La aplicación móvil de BPOM también se utilizará para el etiquetado electrónico. En Indonesia, se ha implementado la matriz de datos GS1 con fines de serialización para algunos productos, para lo cual BPOM ya ha desarrollado una aplicación móvil y se agregará la función de etiquetado electrónico. Las etiquetas de papel se pueden quitar. El proyecto piloto durará 2 años.
Próximos pasos
Tener la información de etiquetado disponible como archivo .doc (Word) o .pdf es restrictivo, ya que son formatos "no estructurados". Estos archivos no se pueden usar "digitalmente" y no permiten aprovechar al máximo las posibilidades que ofrece el cambio a un formato más compatible con la web.
El cambio a un "formato estructurado" como eLeaflet o HL7FHIR ofrecerá una serie de ventajas:
- Oportunidad para una mayor transformación digital
- Enlace a registros médicos electrónicos
- Producción de etiquetas personalizadas
- Creación automatizada de otros materiales
- Provisión de evidencia del mundo real.