e-Labeling e eLeaflet nella regione APAC
Il futuro delle informazioni sui farmaci in ASIA: una prospettiva di settore
La disponibilità delle ultime informazioni sui prodotti su siti Web accessibili al pubblico può essere un primo passo importante per migliorare la sicurezza dei pazienti e la fiducia nei medicinali e può aiutare ad accelerare il processo di trasformazione dall'etichettatura cartacea all'etichettatura elettronica. Una migliore accessibilità sui siti Web pubblici migliora l'esperienza utente migliorando la navigazione tra le informazioni sui prodotti, può aumentare la comprensione dell'uso corretto dei medicinali e offre una maggiore familiarità con il profilo di sicurezza ed efficacia del farmaco rispetto ai materiali di etichettatura stampati più convenzionali.
Il ruolo delle informazioni sul prodotto (l'“etichettatura”)
Le informazioni sul prodotto (l'“etichettatura”) sono una componente chiave del dossier di un prodotto, ma anche uno strumento di comunicazione cruciale. Una varietà di formati (cartaceo, elettronico) e tipologie (paziente, HCP) vengono distribuiti in base ai requisiti nazionali. È anche una misura critica di minimizzazione del rischio che comunica i benefici/rischi e le istruzioni per l'uso.
A seconda del paese, la confezione può contenere informazioni per gli operatori sanitari (ad esempio negli Stati Uniti, Giappone e India) o informazioni per i pazienti (ad esempio UE); in Asia, la maggior parte delle confezioni commerciali contiene etichette mirate agli HCP.
Il digitale porta un cambiamento di pensiero
Molta attenzione per quanto riguarda l'etichettatura è stata finora rivolta alla negoziazione del contenuto delle etichette ed alla manutenzione delle informazioni sul prodotto dopo l'approvazione. Si è prestata poca attenzione al modo in cui l'etichetta viene consultata, utilizzata e compresa nella vita reale. Con il passaggio al digitale l'attenzione si sta ora spostando verso l' "esperienza del cliente".
Cos'è l'etichettatura elettronica
Quando parliamo di etichettatura elettronica ci riferiamo in realtà a un elenco di funzionalità la cui implementazione può essere obbligatoria o facoltativa:
- Disponibilità delle ultime informazioni sul prodotto su un sito Web accessibile al pubblico (ad esempio, le informazioni sul prodotto sono facilmente accessibili online).
- Informazioni disponibili in un formato facilmente accessibile (ad esempio, scansionando un codice sulla confezione), adatto ai lettori e agli smartphone (ad esempio, un formato basato sul Web); la maggior parte dei formati deve supportare testo dinamico, contenuti in più lingue e con funzionalità di ricerca.
- Mancanza di etichettatura cartacea dalla confezione commerciale.
- Supporto per informazioni in formati strutturati (ad esempio eLeaflet o FHIR XML)
- Interoperabilità tra sistemi (ad esempio condivisione di informazioni sui prodotti tra dispositivi indossabili, ePrescription e cartelle cliniche elettroniche).
Perché è importante?
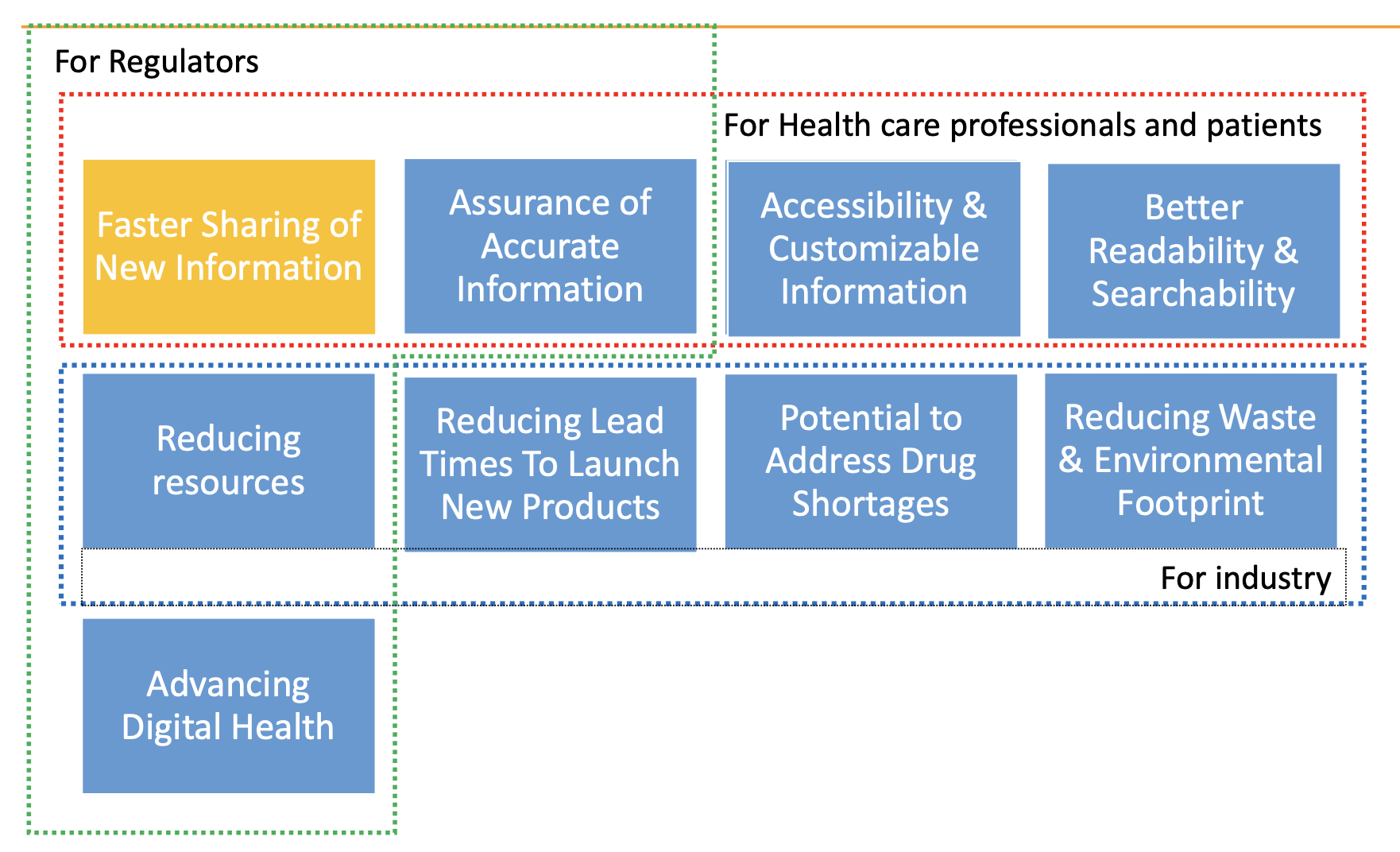
L'etichettatura elettronica può migliorare:
- Accessibilità e comprensione delle informazioni più recenti sui prodotti per pazienti ed operatori sanitari.
- Aderenza alla terapia.
- Risultati per i pazienti.
- Efficienza dei processi produttivi e riduzione degli sprechi di carta.
Vantaggi dell'etichettatura elettronica
Preoccupazioni:
- Competenze digitali: gli individui con competenze digitali insufficienti, come gli anziani, potrebbero avere difficoltà ad accedere alle informazioni sui prodotti in formato elettronico.
- Mancanza di accesso a Internet: nelle aree rurali o in situazioni di emergenza l'accesso a Internet potrebbe essere limitato o non disponibile.
Implementazione dell'e-Labelling in Giappone
- PMDA ha richiesto versioni SGML del JPI (etichettatura HCP) per molti anni e ha iniziato a passare a XML nel 2019.
- A dicembre 2019 il "Pharmaceuticals and Medical Devices Act" è stato modificato per introdurre ufficialmente l'e-Labelling, sostituendo l'etichettatura cartacea che consente a tutti gli operatori sanitari di accedere alle informazioni aggiornate sull'etichetta.
- Il codice a barre GS1 deve essere stampato sulla scatola esterna in modo che gli operatori sanitari possano accedere alle informazioni sull'etichetta. Un'applicazione mobile per la lettura dei codici a barre GS1 è disponibile da maggio 2021.
- L'applicazione dell'emendamento "Pharmaceuticals and Medical Devices Act" è stata implementata il 1° agosto 2021.
- Dopo un periodo di transizione di 2 anni, il requisito per l'etichettatura cartacea è stato rimosso alla fine di luglio 2023.
Stampa su richiesta e accesso ai foglietti illustrativi cartacei
Il titolare dell'autorizzazione all'immissione in commercio (in collaborazione con un grossista, se necessario) deve fornire una copia cartacea del foglietto illustrativo del prodotto su richiesta, in particolare è tenuto a:
- Fornire foglietti illustrativi in formato cartaceo a istituti medici e farmacie alla consegna iniziale dei prodotti.
- Fornire tempestivamente eventuali aggiornamenti in formato cartaceo a istituti medici e farmacie.
Caso Giappone: requisiti per le aziende per implementare l'etichettatura elettronica
I principali passi che le aziende devono implementare per un'implementazione dell'etichettatura elettronica sono:
- Caricare le etichette sul sito Web PMDA.
- Completare il collegamento tra il codice GS1 e le informazioni sull'etichettatura.
- Stabilire il processo che include l'aggiornamento della SOP per implementare l'etichettatura elettronica.
- Istruire gli operatori sanitari su come utilizzare l'etichettatura elettronica (uso tramite app e Web).
Valutazione dell'impatto dell'imballaggio per l'etichettatura elettronica
I ruoli dell'imballaggio:
Proteggere e preservare i prodotti durante il trasporto, lo stoccaggio e la distribuzione dal confezionamento iniziale alla fine del consumo del prodotto.
Ruoli critici dell'inserto di imballaggio:
- È un componente funzionale e tangibile dell'imballaggio.
- Aiuta la stabilità del prodotto nel contenitore durante il trasporto
- Può fornire alcuni gradi di protezione dalla luce e isolamento termico
Una valutazione del rischio di imballaggio è un MUST prima di qualsiasi implementazione dell'etichettatura elettronica.
Giappone: quali metodi vengono utilizzati per consultare le informazioni aggiornate sul prodotto
Nel 2022, MHLW e PMDA hanno condotto un sondaggio incentrato, tra gli altri, sull'impatto della digitalizzazione degli inserti di imballaggio, i principali risultati di questo sondaggio sono:
- Il 75,6% degli ospedali e il 48,1% delle farmacie visitano il sito Web PMDA per vedere le ultime informazioni sull'inserto di imballaggio
- Il 47,9% e il 55,0%, rispettivamente, delle strutture intervistate utilizzano il proprio sistema interno come il sistema di cartella clinica elettronica e il sistema informatico delle ricevute.
- Il 75,2% degli ospedali e il 71,4% delle farmacie fanno riferimento anche al foglietto illustrativo cartaceo
- Solo l'1,7% degli ospedali e il 2,7% delle farmacie si affidano esclusivamente ai foglietti illustrativi cartacei
Prospettive delle iniziative di etichettatura elettronica nei mercati asiatici
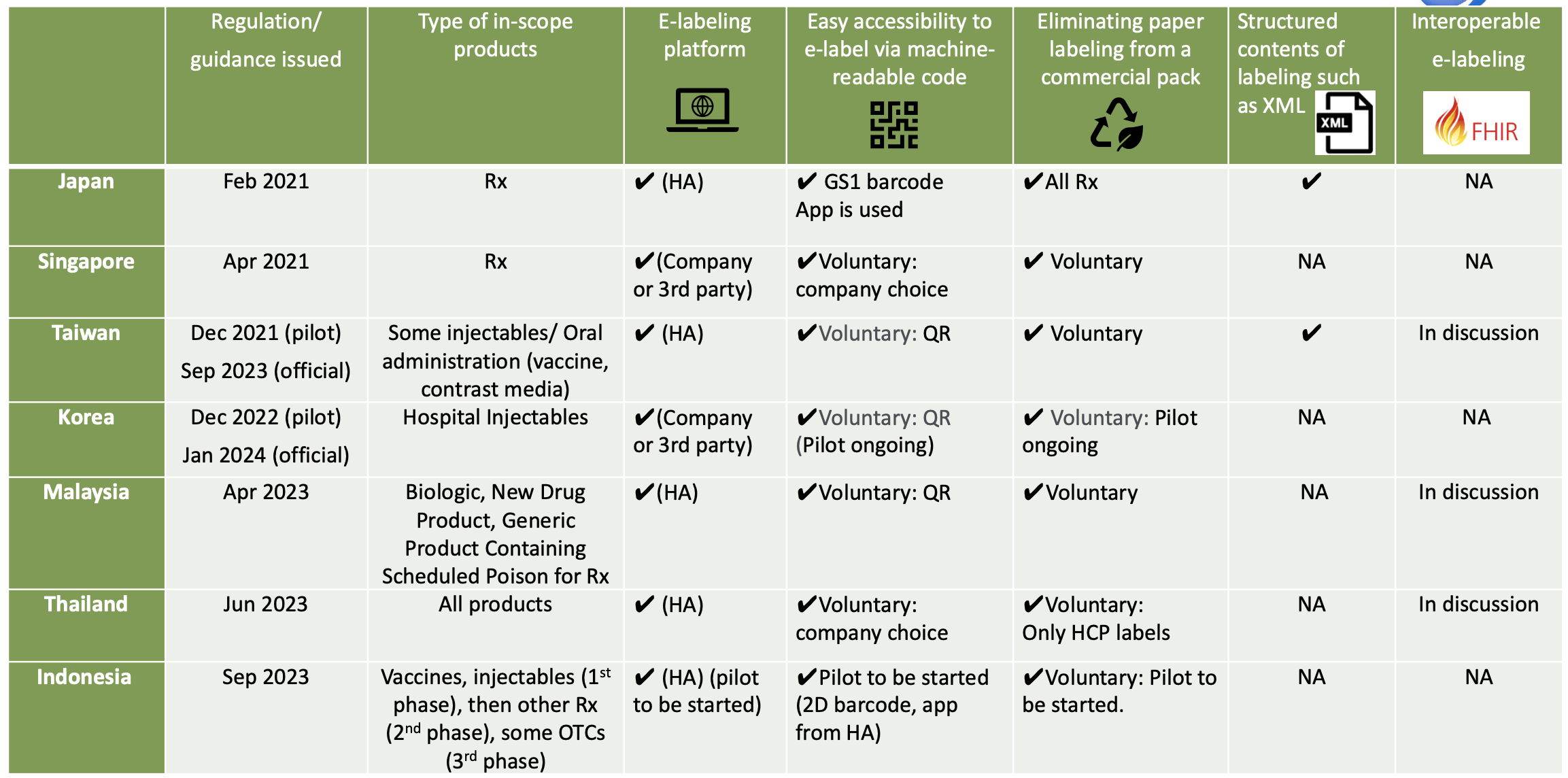
Iniziative di etichettatura elettronica in Asia
In Thailandia, la FDA thailandese ha annunciato ufficialmente che l'etichettatura elettronica è stata completamente implementata per le nuove registrazioni tramite invio elettronico dal 23 giugno 2023. L'implementazione dell'etichettatura elettronica è obbligatoria per le nuove domande di registrazione presentate dopo la data annunciata. Il codice di accessibilità, come il codice QR, deve essere indicato sulla confezione del prodotto. Una volta scansionato il codice di accessibilità, le informazioni sul prodotto per gli operatori sanitari e i pazienti sono disponibili come file PDF dal sito Web della FDA thailandese. L'etichettatura cartacea per gli operatori sanitari può essere rimossa grazie all'implementazione dell'etichettatura elettronica, ma il PIL è richiesto per l'etichettatura fisica.
A Singapore, l'HSA ha pubblicato l'etichettatura per gli operatori sanitari e per i pazienti sul proprio sito Web, ma il sito Web non viene utilizzato in relazione allo studio pilota sull'etichettatura elettronica. La guida definitiva sull'etichettatura elettronica dei prodotti terapeutici* è stata pubblicata ed è entrata in vigore dal 30 aprile 2021. È volontario per le aziende implementare l'etichettatura elettronica laddove le etichette fisiche non devono essere distribuite con la confezione. Alcune aziende hanno avviato studi pilota sull'etichettatura elettronica utilizzando codici QR e codici Data Matrix che collegano la confezione al PI.
In Malesia, sia l'etichettatura per gli operatori sanitari che quella per i pazienti sono pubblicate sul sito Web Malaysia HA (NPRA). NPRA ha pubblicato la Linea guida sull'etichettatura elettronica (e-Labelling) per i prodotti farmaceutici nell'aprile 2023 ed è entrata in vigore il 1° maggio 2023. L'etichettatura elettronica è definita come la fornitura di informazioni di prodotto approvate che includono il foglietto illustrativo (PI) e/o il foglietto illustrativo per il consumatore (RiMUP) elettronicamente tramite un codice Quick Response (QR) leggibile dalla macchina sulla scatola esterna/etichetta interna del prodotto che si collega al sistema NPRA QUEST.
In Indonesia, BPOM ha pubblicato la Guida all'implementazione del progetto pilota di etichettatura elettronica il 14 settembre 2023. Nel progetto pilota, l'etichettatura elettronica sarà disponibile sul sito Web BPOM tramite codice a barre di serializzazione (QR o matrice dati GS1). Anche l'applicazione mobile BPOM verrà utilizzata per scopi di etichettatura elettronica. In Indonesia, la matrice dati GS1 è stata implementata per scopi di serializzazione per alcuni prodotti, per i quali BPOM ha già sviluppato un'applicazione mobile e verrà aggiunta la funzione di e-Labelling. Le etichette cartacee possono essere rimosse. Il progetto pilota durerà 2 anni.
Prossimi passi
Avere informazioni di etichettatura disponibili come file in formato .doc (Word) o .pdf è restrittivo in quanto si tratta di formati "non strutturati". Questi formati non possono essere utilizzati "digitalmente" e non consentono di sfruttare appieno le possibilità offerte dal passaggio a un formato più adatto al web.
Il passaggio a un "formato strutturato" come eLeaflet o HL7FHIR offrirà una serie di vantaggi:
- Opportunità per un'ulteriore passo verso una completa trasformazione digitale
- Collegamento alle cartelle cliniche elettroniche
- Produzione di etichette personalizzate
- Creazione automatizzata di altri materiali informativi (ad esempio Schede per Segnalazione Reazioni Avverse digitali)
- Fornitura di informazioni sull'utilizzo dei prodotti e delle informazioni nel mondo reale (ad esempio raccolta delle domande più frequenti dei pazienti ed utilizzatori di un prodotto).