Étiquetage électronique et brochures électroniques dans la région APAC
L'avenir des informations sur les médicaments en Asie : une perspective industrielle
La mise à disposition des dernières informations sur les produits sur des sites Web accessibles au public peut constituer une première étape importante pour améliorer la sécurité des patients et la confiance dans les médicaments et peut contribuer à accélérer le processus de transformation de l'étiquetage papier vers l'étiquetage électronique. Une meilleure accessibilité sur les sites Web publics améliore l'expérience utilisateur en améliorant la navigation autour des informations sur les produits, peut accroître la compréhension de l'utilisation correcte des médicaments et permet de mieux connaître le profil de sécurité et d'efficacité du médicament par rapport aux supports d'étiquetage imprimés plus conventionnels.
Le rôle des informations sur le produit (l'« étiquetage »)
Les informations sur le produit (l'« étiquetage ») sont un élément clé du dossier soumis, mais aussi un outil de communication crucial. Différents formats (papier, électronique) et types (patient, professionnel de la santé) sont distribués en fonction des exigences nationales. Il s'agit également d'une mesure essentielle de minimisation des risques pour communiquer les avantages/risques et les instructions d'utilisation
Selon le pays, l'emballage peut contenir des informations destinées aux professionnels de la santé (par exemple, aux États-Unis, au Japon et en Inde) ou des informations destinées aux patients (par exemple, dans l'UE) ; en Asie, la plupart des emballages commerciaux contiennent un étiquetage destiné aux professionnels de la santé.
Le numérique apporte un changement de mentalité
Jusqu'à présent, l'accent a été mis en grande partie sur la négociation du contenu et la maintenance des informations sur le produit après l'approbation. Peu d'attention a été accordée à la manière dont l'étiquette est consultée, utilisée, comprise et respectée dans la vie réelle. Avec le numérique, l'accent est désormais mis sur « l'expérience client ».
Qu'est-ce que l'étiquetage électronique ?
Lorsque nous parlons d'étiquetage électronique, nous faisons en réalité référence à une liste d'implémentations obligatoires ou facultatives :
- Disponibilité des dernières informations sur le produit sur un site Web accessible au public (c'est-à-dire que les informations sur le produit sont facilement accessibles en ligne).
- Informations disponibles dans un format facilement accessible (c'est-à-dire en scannant un code sur l'emballage), adapté au lecteur et au smartphone (c'est-à-dire un format basé sur le Web) ; la plupart des formats doivent prendre en charge le texte redimensionnable, plusieurs langues et le contenu consultable.
- Absence d'étiquetage papier dans l'emballage commercial.
- Prise en charge des informations dans un contenu structuré (par exemple, XML FHIR)
- Interopérabilité entre les systèmes (c'est-à-dire partage des informations sur les produits entre les appareils portables, les ordonnances électroniques et les dossiers de santé électroniques).
Pourquoi est-ce important ?
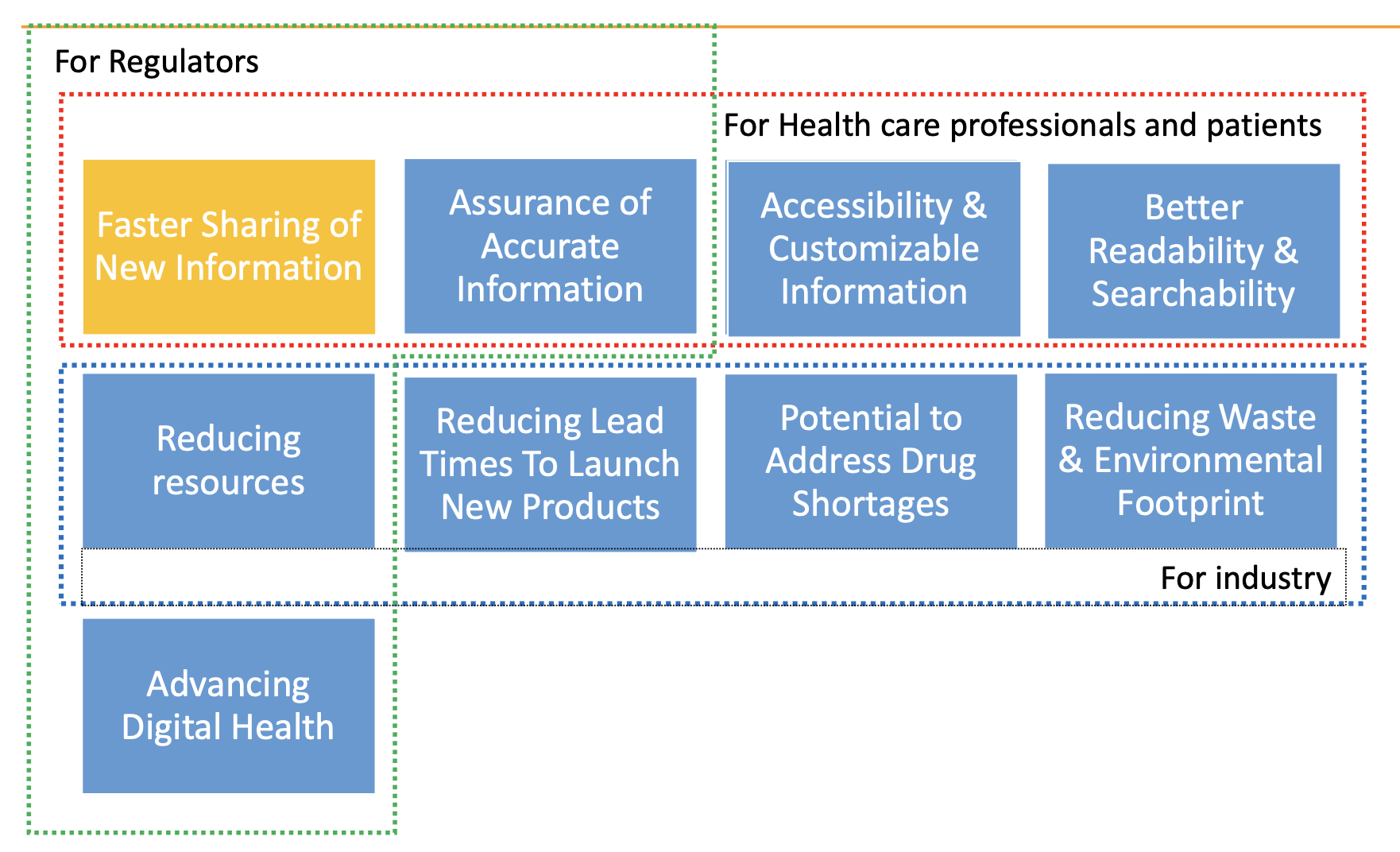
L'étiquetage électronique peut améliorer :
- L'accessibilité et la compréhension des informations les plus récentes sur les produits pour les patients et les professionnels de la santé.
- L'observance.
- Les résultats pour les patients.
- L'efficacité des processus et la réduction du gaspillage de papier.
Avantages de l'étiquetage électronique
Préoccupations :
- Compétences numériques : les personnes ayant des compétences numériques insuffisantes, comme les personnes âgées, peuvent avoir des difficultés à accéder aux informations sur les produits au format électronique.
- Manque d'accès à Internet : dans les zones rurales ou dans les situations d'urgence, l'accès à Internet peut être limité ou indisponible.
Mise en œuvre de l'étiquetage électronique au Japon
- La PMDA exige depuis de nombreuses années des versions SGML du JPI (étiquetage des professionnels de la santé) et a commencé à passer au XML en 2019.
- En décembre 2019, la « Loi sur les produits pharmaceutiques et les dispositifs médicaux » a été modifiée pour introduire officiellement l'étiquetage électronique, remplaçant l'étiquetage papier et le schéma d'accompagnement nécessaire permettant à tous les professionnels de la santé d'accéder aux informations d'étiquetage à jour.
- Le code-barres GS1 doit être imprimé sur la boîte extérieure afin que les professionnels de la santé puissent accéder aux informations d'étiquetage. Une application mobile pour lire les codes-barres GS1 est disponible depuis mai 2021.
- L'application de l'amendement à la « Loi sur les produits pharmaceutiques et les dispositifs médicaux » a été mise en œuvre le 1er août 2021.
- Après une période de transition de 2 ans, l'exigence d'étiquetage papier a été supprimée fin juillet 2023.
Impression à la demande et accès aux notices papier
Le titulaire de l'autorisation de mise sur le marché (en coopération avec un grossiste, si nécessaire) doit fournir une copie papier de la notice du produit sur demande, en particulier il est tenu de :
- Fournir des notices d'accompagnement au format papier aux établissements médicaux et aux pharmacies lors de la livraison initiale des produits.
- Fournir des informations révisées au format papier aux établissements médicaux et aux pharmacies en temps opportun.
Cas du Japon : exigences de l'industrie pour une mise en œuvre de l'étiquetage électronique
Les principales tâches que les entreprises doivent mettre en œuvre pour une mise en œuvre de l'étiquetage électronique sont les suivantes :
- Télécharger les étiquettes sur le site Web de la PMDA.
- Compléter le lien entre le code GS1 et les informations d'étiquetage.
- Établir le processus qui comprend la mise à jour du SOP pour mettre en œuvre l'étiquetage électronique.
- Former les professionnels de la santé sur la façon d'utiliser l'étiquetage électronique (utilisation de l'application et du Web).
Évaluation de l'impact de l'emballage pour l'étiquetage électronique
Les rôles de l'emballage :
Protéger et préserver les produits conduits pendant le transport, le stockage et la distribution depuis le confinement initial jusqu'à la fin de la consommation du produit.
Rôles essentiels de la notice d'emballage :
- C'est un composant fonctionnel tangible de l'emballage.
- Elle contribue à la stabilité du produit dans le conteneur pendant le transport
- Elle peut fournir certains degrés de protection contre la lumière et d'isolation thermique
Une évaluation des risques liés à l'emballage est un MUST avant toute mise en œuvre de l'étiquetage électronique.
Japon : méthodes de consultation des dernières informations sur les notices d'emballage
En 2022, le MHLW et le PMDA ont mené une enquête axée, entre autres, sur l'impact de la numérisation des notices d'emballage, les principaux résultats de cette enquête sont les suivants :
- 75,6 % des hôpitaux et 48,1 % des pharmacies visitent le site Web du PMDA pour voir les dernières informations sur les notices d'emballage
- 47,9 % et 55,0 %, respectivement, des établissements interrogés utilisent leur système interne tel que le système de dossier médical électronique et le système informatique de réception.
- 75,2 % des hôpitaux et 71,4 % des pharmacies se réfèrent également à la notice papier
- Seuls 1,7 % des hôpitaux et 2,7 % des pharmacies s'appuient uniquement sur des notices papier
Perspectives des initiatives d'étiquetage électronique sur les marchés asiatiques
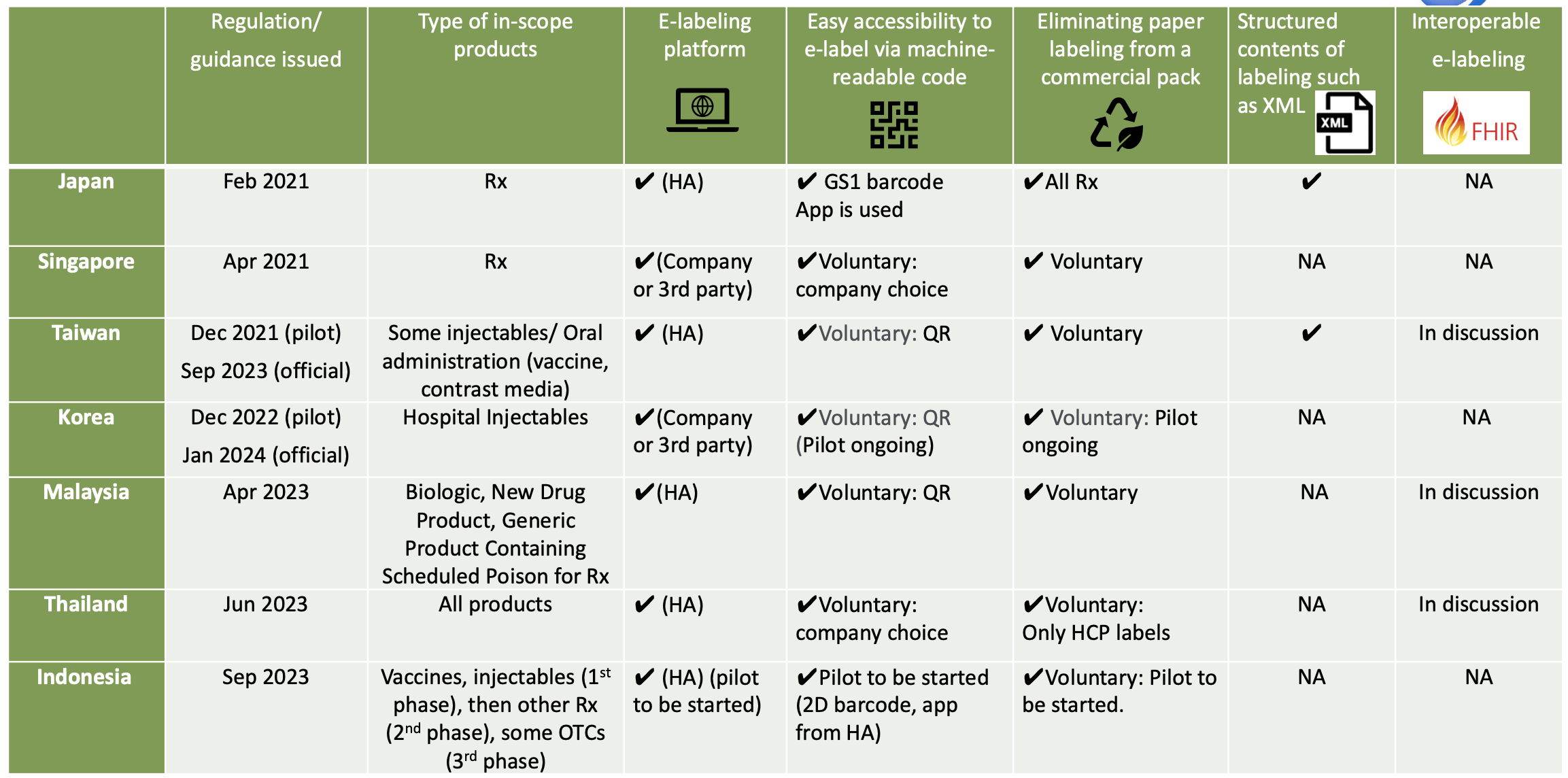
Initiatives d'étiquetage électronique en Asie
En Thaïlande, la FDA thaïlandaise a officiellement annoncé que l'étiquetage électronique a été entièrement mis en œuvre pour les nouvelles inscriptions via la soumission électronique depuis le 23 juin 2023. La mise en œuvre de l'étiquetage électronique est obligatoire pour les nouvelles demandes d'enregistrement soumises après la date annoncée. Le code d'accessibilité tel que le code QR doit être indiqué sur le carton du produit. Une fois le code d'accessibilité scanné, les informations sur le produit pour les professionnels de la santé et les patients sont disponibles sous forme de fichiers PDF sur le site Web de la FDA thaïlandaise. L'étiquetage papier pour les professionnels de santé peut être supprimé en raison de la mise en œuvre de l'étiquetage électronique, mais la PIL est requise pour l'étiquetage physique.
À Singapour, la HSA a publié l'étiquetage des professionnels de santé et des patients sur son site Web, mais son site Web n'est pas utilisé dans le cadre de l'étude pilote d'étiquetage électronique. Les directives finalisées sur l'étiquetage électronique des produits thérapeutiques* ont été publiées et sont entrées en vigueur le 30 avril 2021. Les entreprises sont volontaires pour mettre en œuvre l'étiquetage électronique lorsque les étiquettes physiques ne doivent pas être distribuées avec l'emballage. Certaines entreprises ont lancé des études pilotes d'étiquetage électronique à l'aide de codes QR et de codes Data Matrix reliant l'emballage à l'IP.
En Malaisie, l'étiquetage des professionnels de santé et des patients est publié sur le site Web de la Malaysia HA (NPRA). La NPRA a publié la directive sur l'étiquetage électronique (e-Labelling) des produits pharmaceutiques en avril 2023 et elle est entrée en vigueur le 1er mai 2023. L'étiquetage électronique est défini comme la fourniture d'informations approuvées sur le produit qui comprennent la notice d'emballage (PI) et/ou la notice d'information sur les médicaments destinés au consommateur (RiMUP) par voie électronique via un code à réponse rapide (QR) lisible par machine sur le carton extérieur/l'étiquette intérieure du produit qui renvoie au système NPRA QUEST.
En Indonésie, BPOM a publié le 14 septembre 2023 le Guide de mise en œuvre du projet pilote d'étiquetage électronique. Dans le cadre du projet pilote, l'étiquetage électronique sera disponible sur le site Web de BPOM via un code à barres de sérialisation (QR ou matrice de données GS1). L'application mobile BPOM sera également utilisée à des fins d'étiquetage électronique. En Indonésie, la matrice de données GS1 a été mise en œuvre à des fins de sérialisation pour certains produits, pour lesquels BPOM a déjà développé une application mobile et la fonction d'étiquetage électronique sera ajoutée. Les étiquettes papier peuvent être supprimées. Le projet pilote durera 2 ans.
Prochaines étapes
La disponibilité des informations d'étiquetage sous forme de fichiers .doc (Word) ou .pdf est restrictive car il s'agit de formats « non structurés ». Ces fichiers ne peuvent pas être utilisés « numériquement » et ne permettent pas d'exploiter pleinement les possibilités offertes par le passage à un format plus convivial pour le Web.
Le passage à un « format structuré » comme eLeaflet ou HL7FHIR offrira un certain nombre d'avantages :
- Possibilité de poursuivre la transformation numérique
- Lien vers les dossiers médicaux électroniques
- Production d'étiquettes personnalisées
- Création automatisée d'autres supports
- Fourniture de preuves du monde réel.