ePI: Eine Branchenperspektive
Industrie schlägt schrittweise Einführung von ePI für Patientensicherheit und ökologische Nachhaltigkeit vor
Am 8. Januar 2025 veröffentlichte die Inter-Association Taskforce (IATF) für elektronische Produktinformationen (ePI), eine Kooperation der Branchenverbände AESGP (Association of the European Self-Care Industry), EFPIA (European Federation of Pharmaceutical Industries and Associations) und Medicines for Europe, eine Reihe von Positionspapieren, die sich für die Einführung elektronischer Produktinformationen (ePI) und die Verbesserung der Packungsbeilagen einsetzen.

Die Papiere zeigen, wie Patienten, medizinisches Fachpersonal und die Zivilgesellschaft durch die Umstellung auf ePI von aktuellsten und zugänglichen medizinischen Informationen profitieren und so eine sicherere Anwendung von Arzneimitteln gewährleisten. Mit diesen Dokumenten nimmt die Branche Stellung zu folgenden Themen:
- Wie kann die Einführung von ePI und die schrittweise Abschaffung von Papierpackungsbeilagen vorangetrieben werden?
- Wie kann ePI aus technologischer Sicht praktisch umgesetzt werden?
- Wie kann der Inhalt der Produktinformationen verbessert werden?
- Wie kann die Verwendung von länderübergreifenden Packungsbeilagen gefördert werden?
WICHTIGSTE HÖHEPUNKTE
- Einführung von ePI, Abschaffung von Papier: Die schrittweise Einführung von ePI soll innerhalb von vier Jahren nach Inkrafttreten der überarbeiteten Allgemeinen Arzneimittelverordnung vollständig einsatzbereit sein und der Abschaffung von Papierpackungsbeilagen vorausgehen. Dadurch wird sichergestellt, dass Patienten kontinuierlich über sichere, harmonisierte digitale Plattformen auf wichtige medizinische Informationen zugreifen können. Bestehende ePI-Plattformen wie Websites und Kompendien der nationalen zuständigen Behörden und der Industrie könnten als Lösungen genutzt werden, um den Übergang einzuleiten, bevor ePI vollständig auf dem EMA/HMA-Portal verfügbar ist. Die Abschaffung von Papier bei selbstverabreichten Produkten wird aufgrund individueller Bedürfnisse, administrativer Kapazitäten und produktspezifischer Anforderungen schrittweise erfolgen als bei Produkten, die von medizinischen Fachkräften verabreicht werden.
- Verbesserung der Packungsbeilage: Patienteninformationsbroschüren würden von einem verbesserten Layout und einer besseren Lesbarkeit erheblich profitieren. Es gibt verschiedene Vorschläge, die die korrekte und sichere Anwendung von Arzneimitteln durch die Bereitstellung klarer Informationen zur Verbesserung der Gesundheitskompetenz fördern sollen.
- Patientensicherheit und digitaler Zugang: Da 90 % der EU-Bürger regelmäßig auf das Internet zugreifen Eurostat-Datensätze: Statistik | Eurostat (europa.eu), ermöglicht ePI die Bereitstellung aktueller Packungsbeilagen, interaktiver Elemente, personalisierter Inhalte und barrierefreier Formate wie Großdruck oder Multimedia. Um Inklusivität zu gewährleisten, werden jedoch Alternativen für Personen ohne Internetzugang beibehalten.
- Sicherung der Verfügbarkeit in kleinen Märkten: Mehrländerpackungen, die durch den Einsatz von ePI, Sprachbefreiungen und harmonisierten Kennzeichnungsanforderungen vereinfacht werden, verbessern die Arzneimittelverfügbarkeit in ganz Europa, insbesondere in kleineren Märkten. Sie reduzieren den logistischen Aufwand und fördern eine höhere Flexibilität der Lieferkette.
- Steigerung der regulatorischen Effizienz: Die ePI-Plattform soll regulatorische Prozesse rationalisieren und den Verwaltungsaufwand sowohl für Pharmaunternehmen als auch für Gesundheitsbehörden reduzieren. Das zentralisierte EMA-Portal dient als zentrale Quelle für vertrauenswürdige Informationen und fördert so Transparenz und regulatorische Effizienz in der gesamten EU.
Themenliste
Die Dokumente skizzieren eine strategische Abkehr von den derzeitigen gedruckten Packungsbeilagen hin zu patientenorientierteren Inhalten und einer zugänglichen, umweltfreundlichen digitalen Alternative. Diese soll die pharmazeutischen Abläufe optimieren und gleichzeitig die Patientensicherheit in den Vordergrund stellen.
Die wichtigsten Themen der Papiere sind:
- Einführung elektronischer Produktinformationen und Abschaffung der gedruckten Packungsbeilage
- Alternative Möglichkeiten zur Bereitstellung gedruckter Packungsbeilagen für Arzneimittel
- Hinzufügen von Entsorgungsinformationen zur Kennzeichnung von Arzneimitteln
- Verbesserung der Arzneimittelverfügbarkeit und Verbesserung der Umweltfreundlichkeit durch sprachliche Ausnahmen und elektronische Produktinformationen (ePI)
- Vorschläge zur Unterstützung länderübergreifender Packungsbeilagen und zur Vereinfachung der Lieferkette
Einführung elektronischer Produktinformationen und Abschaffung der gedruckten Packungsbeilage
Die Einführung elektronischer Produktinformationen (ePI) und die Abschaffung der gedruckten Packungsbeilage bieten erhebliche Vorteile für Patienten, medizinisches Fachpersonal, Industrie, Aufsichtsbehörden und die Umwelt, da sie zugängliche und aktuelle Informationen zu Arzneimitteln in einem zugänglichen digitalen Format bieten. ePI stärkt zudem die Agilität der Lieferkette und bietet eine einzigartige Möglichkeit, Engpässe zu minimieren und zu vermeiden und gleichzeitig einen wesentlichen Beitrag zur ökologischen Nachhaltigkeit zu leisten.
Dies ist der IATF-Vorschlag zur Umsetzung:
- Die IATF betont, dass die schrittweise Einführung von ePI (die bereits stattfindet) der Abschaffung von Packungsbeilagen in Papierform vorausgehen sollte. Bestehende ePI-Plattformen wie Websites und Kompendien der nationalen zuständigen Behörden und der Industrie könnten als Lösungen genutzt werden, um den Übergang einzuleiten, bevor ePI vollständig auf dem EMA/HMA-Portal verfügbar ist.
- Die Abschaffung der Packungsbeilage in Papierform sollte zunächst in allen Mitgliedstaaten und unmittelbar nach Inkrafttreten der neuen Gesetzgebung mit Produkten beginnen, die nicht zur Selbstverabreichung bestimmt sind (Produkte, die von medizinischem Fachpersonal verabreicht werden).
- Während die gute Internetverfügbarkeit der EU-Bürger die Argumente für eine breite Einführung von ePI stärkt, ist es entscheidend, der kleinen Minderheit ohne regelmäßigen Internetzugang oder mit eingeschränkten digitalen Fähigkeiten weiterhin zugängliche medizinische Informationen zur Verfügung zu stellen. Daher scheint eine Lösung, die einen Kompromiss zwischen dem vollständigen Verzicht auf Papier und dem vollständigen Erhalt von Papier findet, wie beispielsweise das Drucken an der Ausgabestelle, derzeit die beste Lösung zu sein.
Sind die EU-Bürger bereit für die Nutzung elektronischer Produktinformationen (ePI) und ist die Papierpackungsbeilage noch erforderlich?
Die Bereitschaft der EU-Bürger zur Einführung elektronischer Produktinformationen (ePI) wird durch ermutigende Eurostat-Statistiken unterstützt. Diese zeigen, dass der Internetzugang der EU-Bürger (mindestens einmal pro Woche) im Jahr 2023 bei 90 % liegt (72 % im Jahr 2014) und weiter steigt.2 Dieser Trend wird sich in den kommenden Jahren voraussichtlich deutlich verstärken. Prognosen gehen davon aus, dass bis 2034 der Anteil der EU-Bürger, die regelmäßig das Internet nutzen, insgesamt auf 97 % und in der Altersgruppe der 65- bis 74-Jährigen auf 87 % steigen wird.
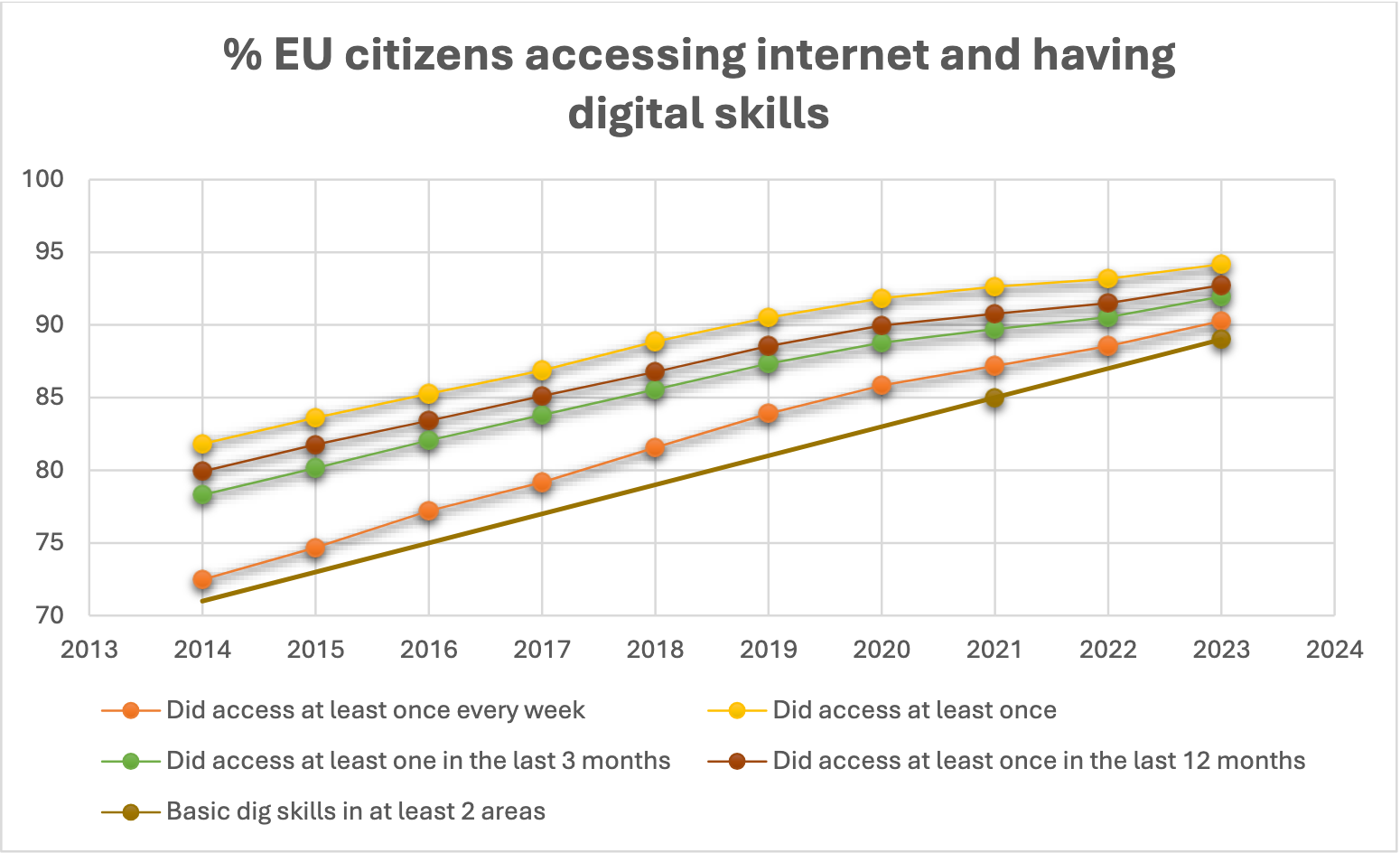
Trotz der positiven Entwicklung hin zu universellem Internetzugang und verbesserten digitalen Kompetenzen setzt sich die Pharmaindustrie weiterhin dafür ein, dass kein Patient beim Übergang von Papier- zu elektronischen Produktinformationen außen vor bleibt.
Zusammenfassend lässt sich sagen, dass die gute Internetverfügbarkeit der EU-Bürger zwar die flächendeckende Einführung elektronischer Produktinformationen (ePI) unterstützt, es jedoch von entscheidender Bedeutung ist, der kleinen Minderheit ohne regelmäßigen Internetzugang weiterhin zugängliche medizinische Informationen zur Verfügung zu stellen. Für diese immer kleiner werdende Minderheit ist es jedoch unverhältnismäßig, ausschließlich auf Papierbeilagen zurückzugreifen. Daher erscheint eine Lösung, die einen Kompromiss zwischen vollständigem Papierverzicht und gleichzeitiger Papiererhaltung findet, wie beispielsweise der Druck direkt an der Abgabestelle, derzeit als die beste Lösung.
Alternative Möglichkeiten zur Bereitstellung gedruckter Packungsbeilagen für Arzneimittel
Drei vielversprechende Ansätze sind:
- Druck durch einen Fachmann, z. B. den Arzneimittelabgeber/-verkäufer oder einen Pflegedienstleister (z. B. in einer Apotheke, einem Gesundheitszentrum, einer Patienten- oder Altenpflegeeinrichtung)
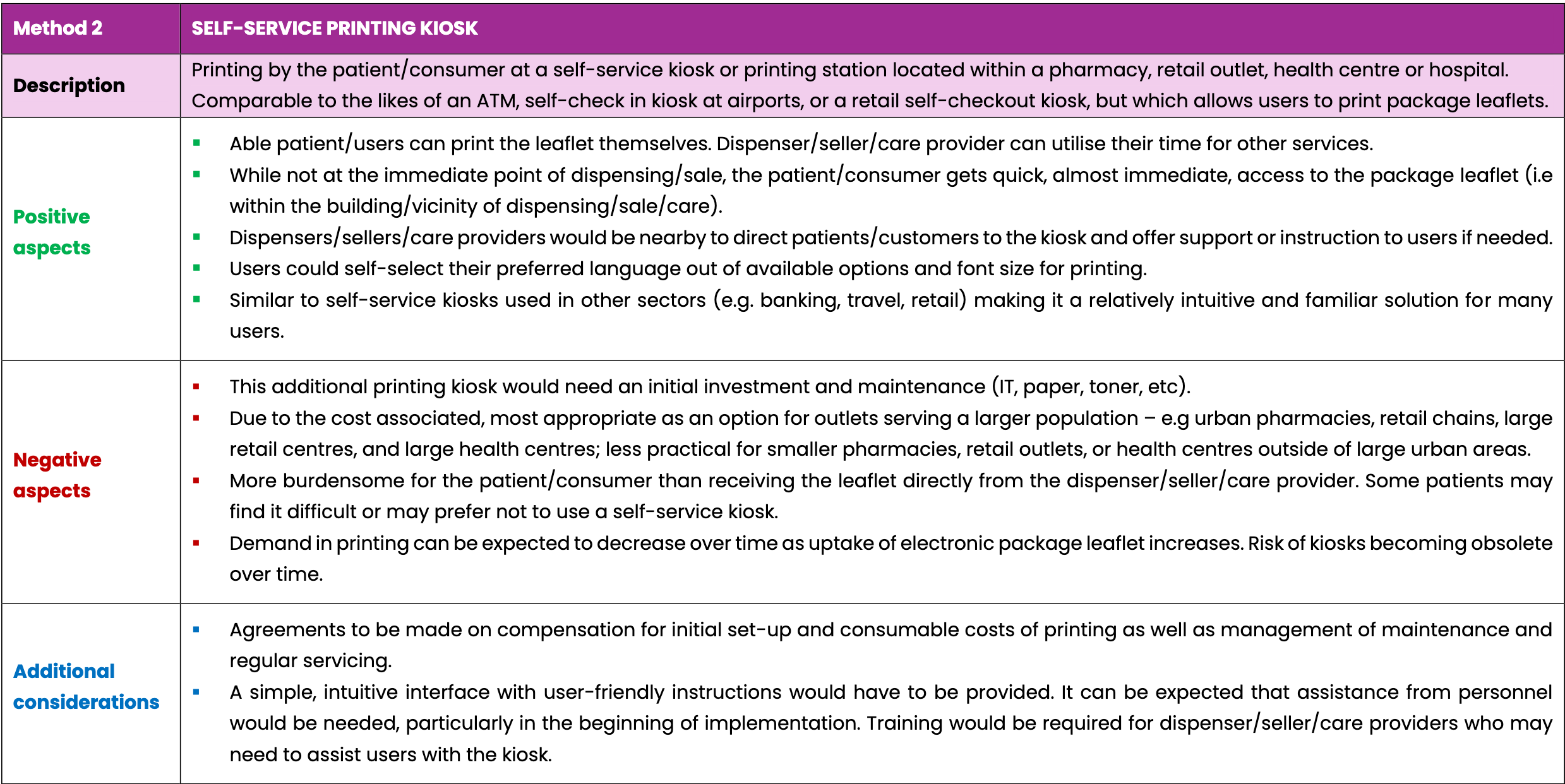
- Druck durch den Patienten an einem Selbstbedienungs-Drucker in einer Apotheke, einem Einzelhandelsgeschäft, einem Gesundheitszentrum oder einem Krankenhaus und
- Druck durch den Patienten an einem Selbstbedienungs-Drucker in einem öffentlichen Druckzentrum an einem geeigneten öffentlichen Ort
Alle drei Optionen basieren auf dem Einsatz von Scantechnologien mit vorhandenen 2D-Datamatrix-Codes oder linearen Barcodes auf der Arzneimittelverpackung. Dadurch wird sichergestellt, dass stets die richtige Packungsbeilage für das abgegebene oder verkaufte Arzneimittel gedruckt wird, und potenzielle Fehler durch manuelles Suchen nach einer bestimmten Packungsbeilage werden vermieden.
Weitere mögliche Lösungen, die in Betracht gezogen wurden, sind die Zustellung von Packungsbeilagen per Kurierdienst nach Verschreibung und die Bereitstellung gedruckter Materialien durch den Hersteller.
Die folgenden Tabellen vergleichen drei Möglichkeiten, Patienten und Anwendern von Arzneimitteln auf Anfrage gedruckte Packungsbeilagen zur Verfügung zu stellen. Die drei aufgeführten Optionen sind nicht abschließend. Sie gehen von einem zukünftigen Szenario aus, in dem Packungsbeilagen ausschließlich elektronisch bereitgestellt werden und nicht mehr in der Verpackung jedes Arzneimittels enthalten sein müssen.


Haftungsausschluss
Dieser Beitrag fasst die wichtigsten Punkte verschiedener Branchenverbände zur Einführung digitaler Beipackzettel (eLeaflet) für Gesundheits- und Arzneimittel zusammen. Der Inhalt dieses Beitrags spiegelt nicht unbedingt die Position von myHealthbox zu diesen Themen wider.
Referenzen
AESGP ist der Verband der europäischen Selbstmedikationsindustrie und eine gemeinnützige Organisation, die die Hersteller von rezeptfreien Arzneimitteln, Nahrungsergänzungsmitteln und medizinischen Geräten zur Selbstmedikation in Europa vertritt. Dieser Bereich wird auch als „Selbstmedikation“ oder „Consumer Healthcare“-Produkte bezeichnet.
EFPIA ist der Europäische Verband der Pharmazeutischen Industrie und Verbände (EFPIA) und vertritt die in Europa tätige biopharmazeutische Industrie.
Medicines for Europe wurde vor über 20 Jahren als European Generic Medicines Association (EGA) mit dem Ziel gegründet, die aufstrebende Generikaindustrie zu vertreten und später auch bioähnliche Arzneimittel in sein Portfolio aufzunehmen. Medicines for Europe vertritt die Pharmaunternehmen, die den größten Anteil der Arzneimittel in ganz Europa liefern, und ist die Stimme der Generika-, Biosimilar- und Mehrwertindustrie.