ePI : point de vue de l’industrie
L’industrie propose un déploiement progressif de l’ePI pour la sécurité des patients et la durabilité environnementale
Le 8 janvier 2025, le groupe de travail interassociations (IATF) sur les informations électroniques sur les produits (ePI), fruit d’une collaboration entre l’AESGP (Association de l’industrie européenne des soins personnels), l’EFPIA (Fédération européenne des associations et industries pharmaceutiques) et Medicines for Europe, a publié une série de documents de position prônant la mise en œuvre des informations électroniques sur les produits (ePI) et l’amélioration du contenu des notices destinées aux patients.

Ces documents montrent comment, grâce à la transition vers l’ePI, les patients, les professionnels de santé et la société civile bénéficieront des informations médicales les plus récentes et accessibles, garantissant une utilisation plus sûre des médicaments.
Par ces documents, l'industrie pharmaceutique exprime sa position sur :
- la transition vers l'ePI et la suppression progressive des notices papier ;
- la mise en œuvre concrète de l'ePI d'un point de vue technologique ;
- l'amélioration du contenu des informations sur les produits ;
- la stimulation de l'utilisation des conditionnements multi-pays.
POINTS CLÉS
- Introduction progressive de l'ePI, suppression progressive du format papier : L'introduction progressive de l'ePI devrait être pleinement opérationnelle dans les quatre ans suivant l'entrée en vigueur de la législation pharmaceutique générale révisée et précédera la suppression progressive des notices papier. Cela garantira aux patients un accès continu aux informations pharmaceutiques essentielles via des plateformes numériques sécurisées et harmonisées. Les plateformes d'ePI existantes, telles que les sites web des autorités nationales compétentes et de l'industrie pharmaceutique, ainsi que les compendiums, pourraient servir de solutions pour amorcer la transition avant que l'ePI ne soit pleinement disponible sur le portail de l'EMA/HMA. La suppression progressive du papier dans les produits auto-administrés sera plus progressive que pour les produits administrés par les professionnels de santé, en raison des besoins individuels, des capacités administratives et des exigences spécifiques aux produits.
- Amélioration des notices d'information destinées aux patients : des améliorations de mise en page et de lisibilité seraient grandement bénéfiques. Plusieurs propositions visent à favoriser une utilisation correcte et sûre des médicaments, en fournissant des informations claires et en améliorant les compétences en santé.
- Sécurité des patients et accès numérique : 90 % des citoyens de l'UE ayant régulièrement accès à Internet ensembles de données Eurostat : Statistiques | Eurostat (europa.eu), l'ePI permettra la mise à disposition de notices actualisées, d'éléments interactifs, de contenus personnalisés et de formats plus accessibles, tels que les gros caractères ou le multimédia. Toutefois, des alternatives seront conservées pour les personnes n'ayant pas accès à Internet afin de garantir l'inclusion. * Garantir la disponibilité sur les petits marchés : Les conditionnements multi-pays, simplifiés par l’utilisation de l’ePI, l’exemption linguistique et les exigences d’étiquetage harmonisées, amélioreront la disponibilité des médicaments en Europe, notamment sur les petits marchés, réduisant ainsi les contraintes logistiques et favorisant une plus grande agilité de la chaîne d’approvisionnement.
- Améliorer l’efficacité réglementaire : La plateforme ePI est conçue pour rationaliser les processus réglementaires et alléger les charges administratives des entreprises pharmaceutiques et des autorités sanitaires. Le portail centralisé de l’EMA servira de source unique d’informations fiables, favorisant ainsi la transparence et l’efficacité réglementaire dans toute l’UE.
Liste des sujets
Les documents décrivent une transition stratégique des notices papier actuelles vers un contenu plus centré sur le patient et une alternative numérique accessible et respectueuse de l’environnement, conçue pour optimiser les opérations pharmaceutiques tout en plaçant la sécurité des patients au premier plan.
Les principaux sujets abordés dans les articles sont :
- Introduction progressive des informations électroniques sur les produits et suppression progressive de la notice papier
- Autres moyens de fournir la notice imprimée des médicaments
- Ajout d’informations sur l’élimination des médicaments sur l’étiquetage des médicaments
- Faciliter la disponibilité des médicaments et les avantages environnementaux grâce aux exemptions linguistiques et aux informations électroniques sur les produits (ePI)
- Propositions pour soutenir les emballages multi-pays et simplifier la chaîne d’approvisionnement
Introduction progressive des informations électroniques sur les produits et suppression progressive de la notice papier
La mise en œuvre des informations électroniques sur les produits (ePI) et la suppression de la notice papier offrent des avantages significatifs pour les patients, les professionnels de santé, l’industrie, les autorités de réglementation et l’environnement en offrant des informations accessibles et actualisées sur les médicaments dans un format numérique accessible. Les ePI renforcent également l’agilité de la chaîne d’approvisionnement et constituent une opportunité unique d’atténuer et de prévenir les pénuries tout en contribuant significativement à la durabilité environnementale.
Voici la proposition de mise en œuvre de l'IATF :
- L'IATF souligne que la mise en place progressive de l'ePI (actuellement en cours) devrait précéder la suppression progressive des notices papier. Les plateformes d'ePI existantes, telles que les sites web des autorités nationales compétentes et de l'industrie, ainsi que les recueils, pourraient servir de solutions pour amorcer la transition avant que l'ePI ne soit pleinement disponible sur le portail de l'EMA/HMA.
- La suppression progressive de la notice papier devrait commencer par les produits non destinés à l'auto-administration (produits administrés par les professionnels de santé), d'abord dans tous les États membres, et immédiatement après l'entrée en vigueur de la nouvelle législation.
- Si l'accès à Internet parmi les citoyens de l'UE plaide en faveur d'une adoption généralisée de l'ePI, il est crucial de continuer à fournir des informations médicales accessibles à la petite minorité ne disposant pas d'un accès régulier à Internet ou possédant des compétences numériques limitées. Par conséquent, une solution conciliant la suppression totale du papier et sa conservation, comme l'impression au point de distribution, semble être l'une des meilleures solutions actuellement.
Les citoyens de l'UE sont-ils prêts à utiliser les informations électroniques sur les produits (ePI) et la notice papier est-elle toujours nécessaire ?
La volonté des citoyens de l'UE d'adopter les informations électroniques sur les produits (ePI) est corroborée par les statistiques encourageantes d'Eurostat, qui révèlent que l'accès à Internet des citoyens de l'UE (au moins une fois par semaine) s'élève à 90 % en 2023 (72 % en 2014) et continue de progresser2. Cette tendance devrait s'accentuer significativement dans les années à venir, les projections indiquant que d'ici 2034, le pourcentage de citoyens de l'UE accédant régulièrement à Internet atteindra 97 % au total, et 87 % chez les 65-74 ans.
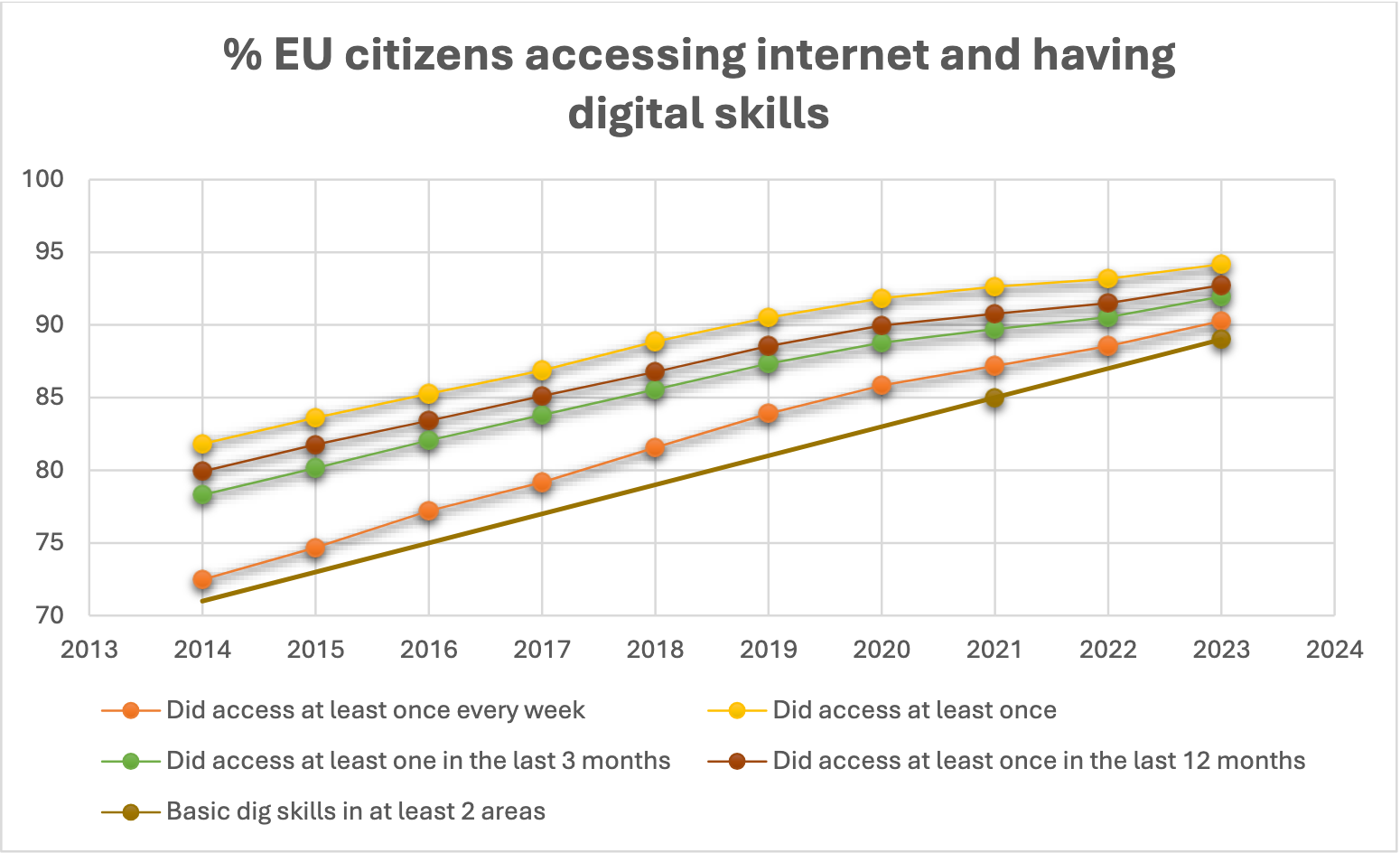
Malgré la tendance positive vers l'accès universel à Internet et le développement des compétences numériques, l'industrie pharmaceutique reste déterminée à garantir qu'aucun patient ne soit laissé pour compte lors de la transition du papier vers les informations produits électroniques.
En conclusion, si l'accès à Internet parmi les citoyens de l'UE plaide en faveur d'une adoption généralisée de l'ePI, il est crucial de continuer à fournir des informations médicales accessibles à la petite minorité qui ne dispose pas d'un accès régulier à Internet. Cependant, maintenir la notice papier pour cette minorité en constante diminution est disproportionné. Par conséquent, une solution conciliant la suppression totale du papier et sa conservation, comme l'impression au point de distribution, semble être l'une des meilleures solutions actuellement. ## Autres moyens de fournir la notice imprimée des médicaments Trois approches prometteuses sont les suivantes :
- L’impression par un professionnel, tel que le distributeur/vendeur du médicament ou le prestataire de soins (par exemple, en pharmacie, dans un centre de santé, chez le patient ou dans un établissement de soins pour personnes âgées)
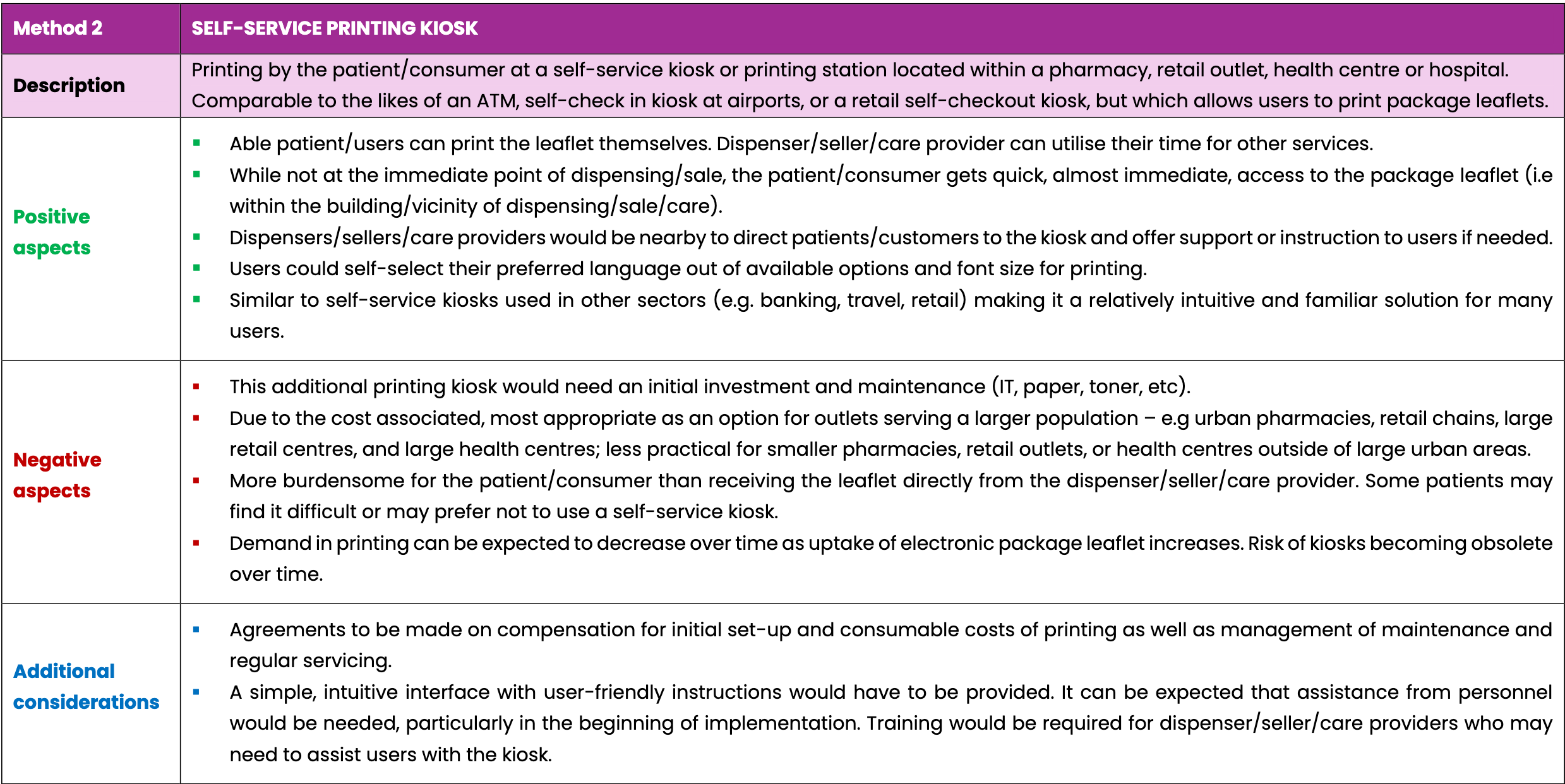
- L’impression par le patient sur une borne d’impression libre-service située dans une pharmacie, un point de vente, un centre de santé ou un hôpital ;
- L’impression par le patient sur une borne libre-service dans un espace public adapté.
Ces trois options prévoient l’utilisation de technologies de numérisation avec les codes Data Matrix 2D ou les codes-barres linéaires existants sur l’emballage du médicament. Cela permettra de garantir que la notice correcte pour le médicament délivré ou vendu est toujours imprimée, évitant ainsi les erreurs potentielles liées à la recherche manuelle d’une notice spécifique.
D’autres solutions possibles ont été envisagées, notamment la livraison des notices par coursier lors de la prescription et la livraison de documents imprimés par le fabricant.
Les tableaux ci-dessous comparent trois solutions possibles pour fournir une version imprimée des notices aux patients et aux consommateurs de médicaments sur demande. Ces trois options ne sont pas exhaustives. Ceci envisage un scénario futur dans lequel les notices seraient fournies uniquement par voie électronique et ne seraient plus requises à l'intérieur de l'emballage de chaque médicament.


Avertissement
Cet article est une synthèse des principaux points soulevés par diverses associations professionnelles concernant l'introduction de la notice numérique (eLeaflet) pour les produits de santé et les médicaments. Son contenu ne reflète pas nécessairement la position de myHealthbox sur ces sujets.
Références
AESGP est l'Association de l'Industrie Européenne des Soins Autonomes (AESGP), une organisation à but non lucratif qui représente les fabricants de médicaments sans ordonnance, de compléments alimentaires et de dispositifs médicaux d'autosoins en Europe, un secteur également appelé « produits d'autosoins » ou « produits de santé grand public ».
EFPIA est la Fédération européenne des associations et industries pharmaceutiques (EFPIA) et représente l'industrie biopharmaceutique en Europe.
Medicines for Europe a été fondée il y a plus de 20 ans sous le nom d'Association européenne des médicaments génériques (EGA) avec pour objectif de représenter l'industrie émergente des médicaments génériques, puis d'inclure les médicaments biosimilaires à son portefeuille. Medicines for Europe représente les laboratoires pharmaceutiques fournissant la plus grande part de médicaments en Europe et est la voix des industries des médicaments génériques, biosimilaires et à valeur ajoutée.