ePi: uma perspectiva da indústria
Indústria propõe implementação gradual do ePI para a segurança do doente e sustentabilidade ambiental
A 8 de janeiro de 2025, a Força-Tarefa Interassociacional (IATF) sobre Informação Eletrónica sobre Produtos (ePI), uma colaboração entre as associações do setor AESGP (Associação da Indústria Europeia de Autocuidado), EFPIA (Federação Europeia das Indústrias e Associações Farmacêuticas) e Medicines for Europe publicou uma série de documentos de posicionamento defendendo a implementação da Informação Eletrónica sobre o Produto (ePI) e a melhoria do conteúdo do folheto informativo para o doente.

Os artigos mostram como, ao fazer a transição para o ePI, os doentes, os profissionais de saúde (HCPs) e a sociedade civil beneficiarão da informação médica mais atualizada e acessível, garantindo a utilização mais segura dos produtos medicinais.
Através destes documentos, a indústria está a expressar a sua posição sobre:
- como avançar para o ePI e a eliminação progressiva das bulas em papel,
- como implementar o ePI na prática do ponto de vista tecnológico,
- como o conteúdo da informação do produto pode ser melhorado e
- como o uso de pacotes multipaíses pode ser estimulado.
PRINCIPAIS DESTAQUES
- Introdução gradual do ePI, eliminação gradual do papel: a introdução gradual do ePI deverá estar totalmente operacional no prazo de 4 anos após a entrada em vigor da Legislação Farmacêutica Geral revista e precederá a eliminação gradual dos folhetos impressos. Isto irá garantir que os doentes têm acesso contínuo a informações médicas críticas através de plataformas digitais seguras e harmonizadas. As plataformas ePI existentes, como os websites e compêndios da Autoridade Nacional Competente e da Indústria, podem ser utilizadas como soluções para iniciar a transição antes de o ePI estar totalmente disponível no portal EMA/HMA. A eliminação gradual da utilização de papel nos produtos autoadministrados será mais gradual do que nos produtos administrados por profissionais de saúde, devido às necessidades individuais, às capacidades administrativas e aos requisitos específicos do produto.
- Melhoria do PIL: os folhetos informativos para os doentes beneficiariam muito de melhorias no layout e na legibilidade. Existem diversas propostas para beneficiar o uso correto e seguro dos medicamentos, fornecendo informações claras para aumentar a literacia em saúde.
- Segurança do doente e acesso digital: com 90% dos cidadãos da UE a aceder regularmente à internet conjuntos de dados do Eurostat: estatísticas | Eurostat (europa.eu), o ePI permitirá a disponibilização de folhetos atualizados, elementos interativos, conteúdos personalizados e formatos mais acessíveis, como letras grandes ou multimédia. No entanto, serão mantidas alternativas para quem não tem acesso à internet para garantir a inclusão.
- Salvaguarda da disponibilidade em mercados pequenos: as embalagens multipaíses, que são simplificadas pelo uso de ePI, isenção linguística e requisitos de rotulagem harmonizados, melhorarão a disponibilidade de medicamentos em toda a Europa, especialmente em mercados mais pequenos, reduzindo os encargos logísticos e promovendo uma maior agilidade na cadeia de abastecimento.
- Aumento da eficiência regulamentar: a plataforma ePI foi concebida para agilizar os processos regulamentares, reduzindo os encargos administrativos tanto para as empresas farmacêuticas como para as autoridades de saúde. O portal centralizado da EMA servirá como uma fonte única de informação fiável, promovendo a transparência e a eficiência regulamentar em toda a UE.
Lista de tópicos
Os documentos descrevem uma mudança estratégica dos atuais folhetos impressos para um conteúdo mais centrado no doente e uma alternativa digital acessível e amiga do ambiente, concebida para otimizar as operações farmacêuticas, mantendo a segurança do doente em primeiro lugar.
Os principais temas abordados nos artigos são:
- Implementação gradual da informação electrónica sobre os produtos e eliminação gradual do folheto informativo em papel
- Formas Alternativas de Fornecimento da Bula Impressa de Medicamentos
- Adicionar informação sobre a eliminação na rotulagem de medicamentos.
- Facilitar a disponibilidade de medicamentos e benefícios ambientais através de isenções linguísticas e informações eletrónicas sobre produtos (ePI).
- Propostas para apoiar pacotes multi-países e simplificar a cadeia de abastecimento
Implementação gradual da informação eletrónica sobre os produtos e eliminação gradual do folheto informativo em papel
A implementação da Informação Eletrónica sobre Produtos (ePI) e a remoção da bula em papel oferecem vantagens significativas para os doentes, profissionais de saúde, indústria, entidades reguladoras e o ambiente, oferecendo informações acessíveis e atualizadas sobre medicamentos num formato digital acessível. O ePI também fortalece a agilidade da cadeia de abastecimento e é uma oportunidade única para mitigar e prevenir a escassez, contribuindo significativamente para a sustentabilidade ambiental.
Esta é a proposta da IATF para implementação:
- A IATF sublinha que a implementação gradual do ePI (que já está a ocorrer atualmente) deve preceder a eliminação gradual das bulas em papel. As plataformas ePI existentes, como os websites e compêndios da Autoridade Nacional Competente e da Indústria, podem ser utilizadas como soluções para iniciar a transição antes de o ePI estar totalmente disponível no portal EMA/HMA. 2.º A eliminação gradual da bula em papel deve começar pelos produtos não destinados à autoadministração (produtos administrados por profissionais de saúde), primeiro em todos os Estados-Membros e imediatamente após a entrada em vigor da nova legislação.
- Embora o cenário de acesso à Internet entre os cidadãos da UE reforce o argumento a favor da adoção generalizada do ePI, é crucial continuar a fornecer informações médicas acessíveis à pequena minoria sem acesso regular à internet ou com competências digitais limitadas. Assim sendo, uma solução que estabeleça um equilíbrio entre a remoção completa do papel e a retenção total do papel, como a impressão no ponto de dispensa, parece ser uma das melhores soluções neste momento.
Os cidadãos da UE estão prontos para utilizar o ePI e a bula em papel ainda é necessária?
A disponibilidade dos cidadãos da UE para a adoção de informações eletrónicas sobre produtos (ePI) é apoiada por estatísticas encorajadoras do Eurostat, que revelam que o acesso à Internet entre os cidadãos da UE (pelo menos uma vez por semana) é de 90% em 2023 (72% em 2014) e continua a aumentar2. Prevê-se que esta tendência aumente significativamente nos próximos anos, com projecções a indicar que, até 2034, a percentagem de cidadãos da UE que acedem regularmente à internet aumentará para 97% no geral e para 87% entre aqueles com idades compreendidas entre os 65 e os 74 anos.
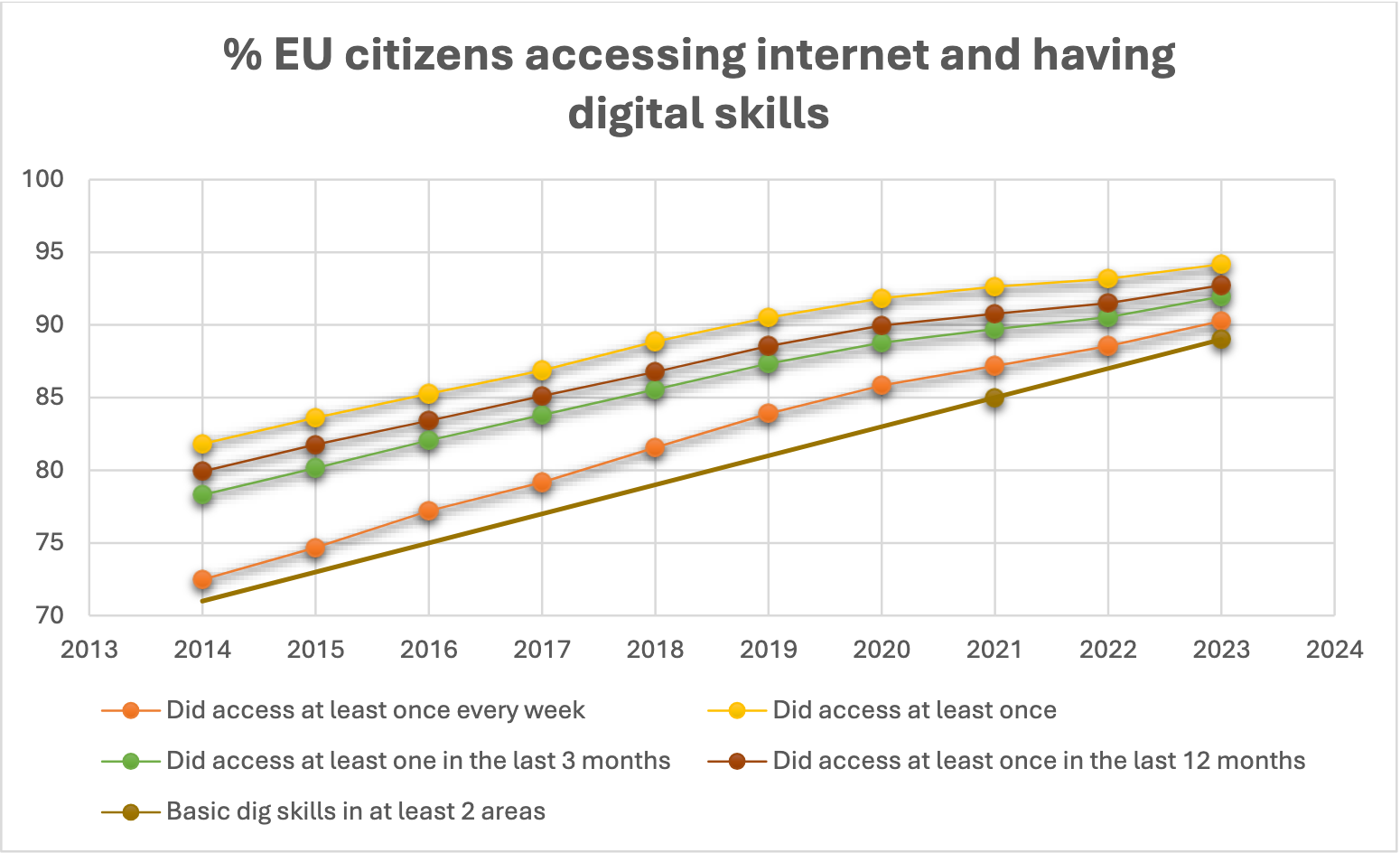
Apesar da trajetória positiva em direção ao acesso universal à internet e ao aumento das competências digitais, a indústria farmacêutica continua empenhada em garantir que nenhum doente é deixado para trás na transição da informação dos produtos em papel para a eletrónica.
Concluindo, embora o cenário de acesso à internet entre os cidadãos da UE fortaleça o argumento a favor da adoção generalizada do ePI, é crucial continuar a fornecer informação médica acessível à pequena minoria sem acesso regular à internet. No entanto, manter o folheto impresso exclusivamente para esta minoria cada vez mais pequena é desproporcional. Assim sendo, uma solução que encontre um equilíbrio entre a remoção completa do papel e a retenção total do papel, como a impressão no ponto de distribuição, parece ser uma das melhores soluções neste momento.
Formas alternativas de fornecer a bula impressa dos medicamentos
Três abordagens promissoras são:
- Impressão por um profissional, como o distribuidor/vendedor de medicamentos ou o prestador de cuidados (por exemplo, numa farmácia, centro de saúde, unidade de cuidados a doentes ou idosos)
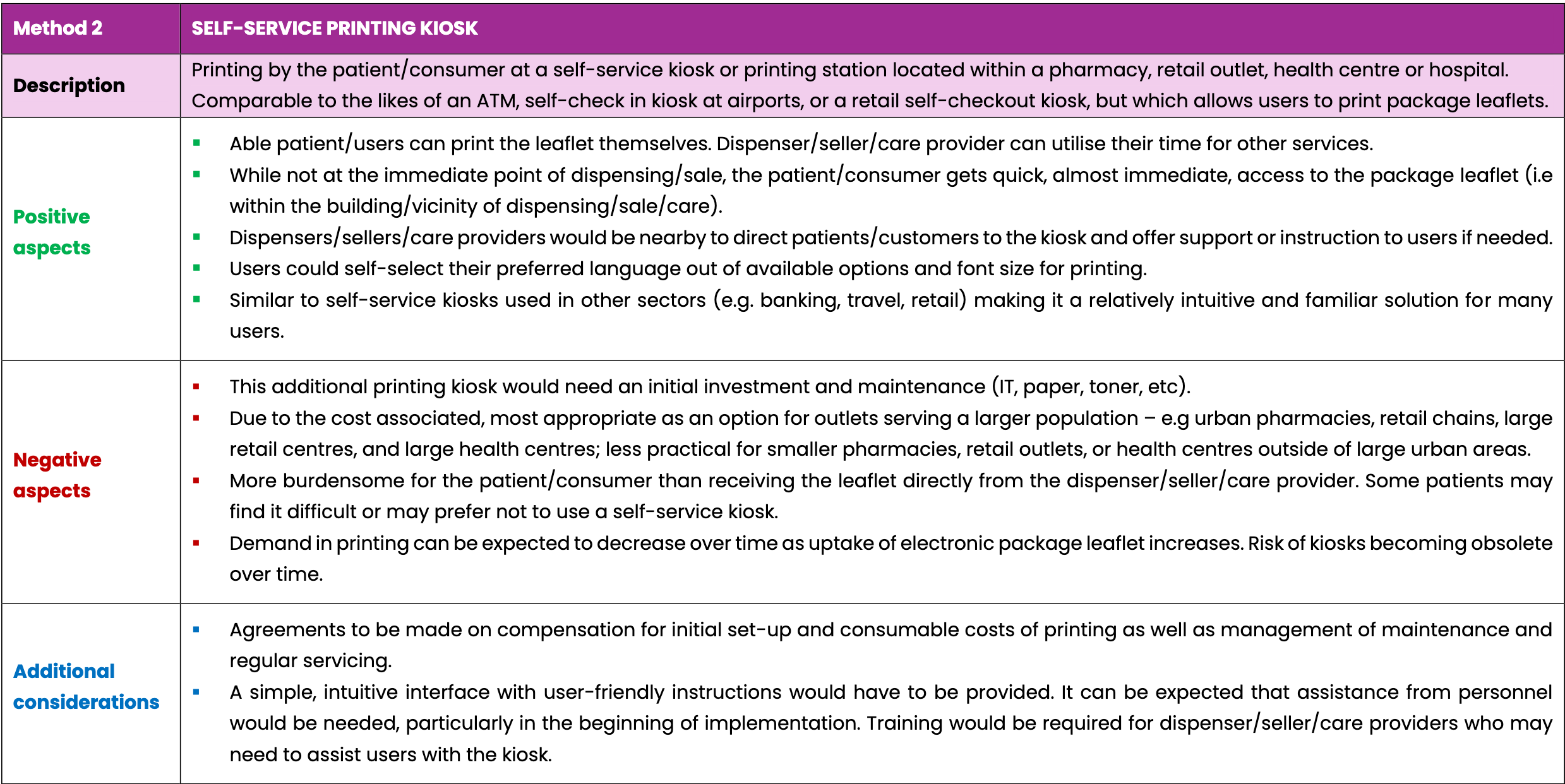
- Impressão pelo doente num quiosque de impressão de self-service localizado numa farmácia, ponto de venda, centro de saúde ou hospital, e
- Impressão pelo doente num quiosque de self-service num centro de impressão comunitário em local público adequado
Todas as três opções prevêem a utilização de tecnologias de digitalização com códigos de matriz de dados 2D existentes ou códigos de barras lineares na embalagem do medicamento. Isto irá garantir que o folheto correto para o medicamento dispensado ou vendido é sempre impresso, evitando possíveis erros na pesquisa manual de um folheto específico.
Outras soluções possíveis que foram consideradas incluem a entrega de bulas por correio no momento da prescrição e a entrega de recursos impressos pelo fabricante.
As tabelas abaixo comparam três formas possíveis de fornecer uma cópia impressa de bulas aos doentes e consumidores de medicamentos, mediante pedido. As três opções enumeradas não são exaustivas. Isto considera um cenário futuro em que as bulas são fornecidas apenas por via eletrónica e já não são necessárias dentro da embalagem de cada medicamento.


Isenção de responsabilidade
Esta publicação é um resumo destacando os principais pontos apresentados por várias associações do setor em relação à introdução do folheto digital (eLeaflet) para produtos de saúde e medicamentos. O conteúdo deste post não reflete necessariamente a posição do myHealthbox em relação a estes tópicos.
Referências
AESGP é a Associação da Indústria Europeia de Autocuidado, uma organização sem fins lucrativos que representa os fabricantes de medicamentos não sujeitos a receita médica, suplementos alimentares e dispositivos médicos de autocuidado na Europa, uma área também conhecida como produtos de “autocuidado” ou “saúde do consumidor”.
EFPIA é a Federação Europeia das Indústrias e Associações Farmacêuticas (EFPIA) que representa a indústria biofarmacêutica que opera na Europa.
A Medicines for Europe começou há mais de 20 anos como Associação Europeia de Medicamentos Genéricos (EGA) com o objetivo de representar a emergente indústria de genéricos e, posteriormente, cresceu para incluir medicamentos biossimilares no seu portefólio. A Medicines for Europe representa as empresas farmacêuticas que fornecem a maior parte dos medicamentos na Europa e é a voz das indústrias de genéricos, biossimilares e de valor acrescentado.