ePi: una prospettiva industriale
L'industria propone l'implementazione graduale dell'ePI per la sicurezza dei pazienti e la sostenibilità ambientale
L'8 gennaio 2025, la Taskforce interassociativa (IATF) sulle Informazioni Elettroniche sui Prodotti (ePI), una collaborazione tra le associazioni di settore AESGP (Association of the European Self-Care Industry), EFPIA (European Federation of Pharmaceutical Industries and Associations) e Medicines for Europe, ha pubblicato una serie di position paper a sostegno dell'implementazione delle Informazioni Elettroniche sui Prodotti (ePI) e del miglioramento del contenuto dei foglietti illustrativi per i pazienti.

I documenti illustrano come, con il passaggio all'ePI, pazienti, operatori sanitari e società civile beneficeranno delle informazioni medicinali più aggiornate e accessibili, garantendo un uso più sicuro dei medicinali.
Attraverso questi documenti, l'industria esprime la propria posizione su:
- come passare all'ePI e alla progressiva eliminazione dei foglietti illustrativi cartacei,
- come implementare concretamente l'ePI dal punto di vista tecnologico,
- come migliorare il contenuto delle informazioni sul prodotto e
- come incentivare l'uso di confezioni multi-paese.
PUNTI SALIENTI
- Introduzione graduale dell'ePI, eliminazione graduale dei foglietti illustrativi cartacei: si propone che l'introduzione graduale dell'ePI sia pienamente operativa entro 4 anni dall'entrata in vigore della legislazione farmaceutica generale rivista e precederà l'eliminazione graduale dei foglietti illustrativi cartacei. Ciò garantirà ai pazienti un accesso continuo alle informazioni medicinali critiche tramite piattaforme digitali sicure e armonizzate. Le piattaforme ePI esistenti, come i siti web delle Autorità Nazionali Competenti e dell'Industria e i compendi, potrebbero essere utilizzate come soluzioni per avviare la transizione prima che l'ePI diventi completamente disponibile sul portale EMA/HMA. L'eliminazione graduale della carta per i prodotti auto-somministrati sarà più graduale rispetto ai prodotti somministrati dagli operatori sanitari, a causa delle esigenze individuali, delle capacità amministrative e dei requisiti specifici del prodotto.
- Miglioramento del foglietto illustrativo: i foglietti illustrativi per i pazienti trarrebbero grande beneficio da miglioramenti di layout e leggibilità. Esistono diverse proposte per favorire un uso corretto e sicuro dei medicinali, fornendo informazioni chiare per migliorare l'alfabetizzazione sanitaria.
- Sicurezza del paziente e accesso digitale: con il 90% dei cittadini dell'UE che accede regolarmente a Internet set di dati Eurostat: Statistiche | Eurostat (europa.eu), ePI consentirà la disponibilità di opuscoli informativi aggiornati, elementi interattivi, contenuti personalizzati e formati più accessibili, come caratteri grandi o contenuti multimediali. Tuttavia, saranno mantenute alternative per coloro che non hanno accesso a internet, al fine di garantire l'inclusività.
- Salvaguardia della disponibilità nei mercati di piccole dimensioni: le confezioni multi-paese, semplificate dall'uso di ePI, dall'esenzione linguistica e dai requisiti di etichettatura armonizzati, miglioreranno la disponibilità dei medicinali in tutta Europa, in particolare nei mercati più piccoli, riducendo gli oneri logistici e favorendo una maggiore agilità della catena di approvvigionamento.
- Miglioramento dell'efficienza normativa: la piattaforma ePI è progettata per semplificare i processi normativi, riducendo gli oneri amministrativi sia per le aziende farmaceutiche che per le autorità sanitarie. Il portale centralizzato dell'EMA fungerà da unica fonte di informazioni affidabili, promuovendo la trasparenza e l'efficienza normativa in tutta l'UE.
Elenco degli argomenti
I documenti delineano un passaggio strategico dagli attuali foglietti illustrativi cartacei a un contenuto più incentrato sul paziente e a un'alternativa digitale accessibile e rispettosa dell'ambiente, progettata per ottimizzare le operazioni farmaceutiche, mantenendo al contempo la sicurezza del paziente in primo piano.
I principali argomenti trattati nei documenti sono:
- Introduzione graduale delle Informazioni di Prodotto Elettroniche ed eliminazione graduale del Foglietto Illustrativo Cartaceo
- Modalità alternative per fornire il Foglietto Illustrativo Stampato dei Medicinali
- Aggiunta di informazioni sullo smaltimento sull'etichettatura dei Medicinali
- Facilitazione della disponibilità dei Medicinali e dei benefici ambientali attraverso esenzioni linguistiche e Informazioni di Prodotto Elettroniche (ePI).
- Proposte per supportare le confezioni multi-paese e semplificare la catena di approvvigionamento
Introduzione graduale delle Informazioni di Prodotto Elettroniche ed eliminazione graduale del Foglietto Illustrativo Cartaceo
L'implementazione delle Informazioni di Prodotto Elettroniche (ePI) e l'eliminazione del Foglietto Illustrativo Cartaceo offrono vantaggi significativi per pazienti, operatori sanitari, industria, autorità di regolamentazione e ambiente, offrendo informazioni accessibili e aggiornate sui medicinali in un formato digitale accessibile. L'ePI rafforza inoltre l'agilità della supply chain e rappresenta un'opportunità unica per mitigare e prevenire le carenze, contribuendo in modo significativo alla sostenibilità ambientale.
Questa è la proposta di attuazione dell'IATF:
- L'IATF sottolinea che l'introduzione graduale dell'ePI (già in corso) dovrebbe precedere l'eliminazione graduale dei foglietti illustrativi cartacei. Le piattaforme ePI esistenti, come i siti web e i compendi delle Autorità Nazionali Competenti e dell'Industria, potrebbero essere utilizzate come soluzioni per avviare la transizione prima che l'ePI diventi completamente disponibile sul portale EMA/HMA.
- L'eliminazione graduale del foglietto illustrativo cartaceo dovrebbe iniziare con i prodotti non destinati all'autosomministrazione (prodotti somministrati da operatori sanitari) in tutti gli Stati membri e subito dopo l'entrata in vigore della nuova legislazione.
- Sebbene il panorama dell'accesso a Internet tra i cittadini dell'UE rafforzi le argomentazioni a favore dell'adozione diffusa dell'ePI, è fondamentale continuare a fornire informazioni medicinali accessibili alla piccola minoranza che non dispone di un accesso regolare a Internet o con competenze digitali limitate. Pertanto, una soluzione che trovi un equilibrio tra la completa eliminazione della carta e il suo completo mantenimento, come la stampa al momento della dispensazione, sembra essere una delle migliori al momento.
I cittadini dell'UE sono pronti per l'uso delle ePI? Il foglietto illustrativo cartaceo è ancora obbligatorio?
La preparazione dei cittadini dell'UE all'adozione delle Informazioni Elettroniche sui Prodotti (ePI) è supportata da incoraggianti statistiche Eurostat, che rivelano che l'accesso a Internet tra i cittadini dell'UE (almeno una volta alla settimana) raggiungerà il 90% nel 2023 (72% nel 2014) e continuerà ad aumentare2. Si prevede che questa tendenza aumenterà significativamente nei prossimi anni, con proiezioni che indicano che entro il 2034 la percentuale di cittadini dell'UE che accedono regolarmente a Internet salirà al 97% complessivo e all'87% tra le persone di età compresa tra 65 e 74 anni.
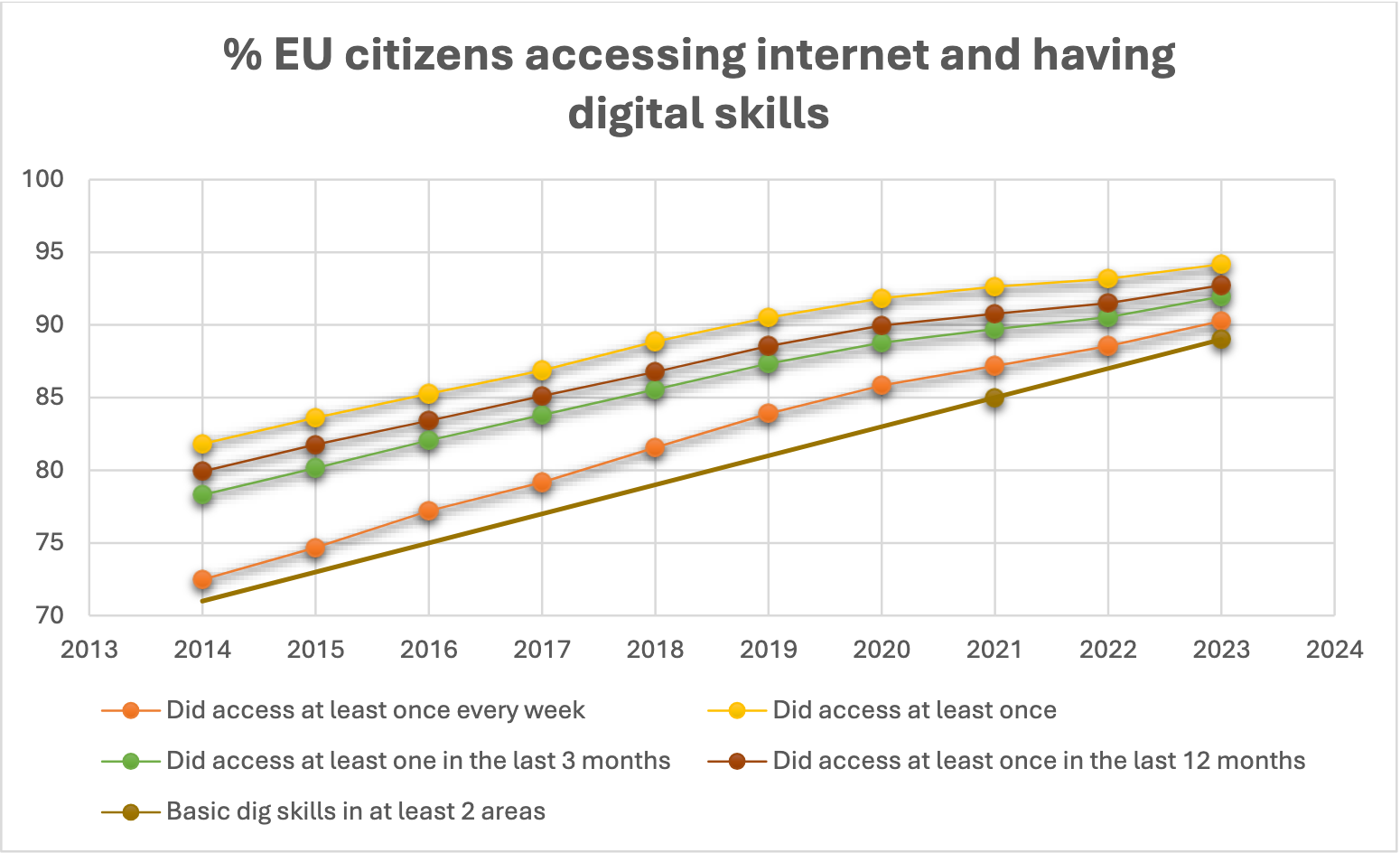
Nonostante la traiettoria positiva verso l'accesso universale a internet e l'aumento delle competenze digitali, l'industria farmaceutica rimane impegnata a garantire che nessun paziente venga lasciato indietro nella transizione dalle informazioni cartacee a quelle elettroniche sui prodotti.
In conclusione, sebbene il panorama dell'accesso a internet tra i cittadini dell'UE rafforzi le argomentazioni a favore dell'adozione diffusa delle ePI, è fondamentale continuare a fornire informazioni mediche accessibili alla piccola minoranza che non dispone di un accesso regolare a internet. Tuttavia, mantenere il foglietto illustrativo interamente cartaceo per questa minoranza in continua diminuzione è sproporzionato. Pertanto, una soluzione che trovi un equilibrio tra la rimozione completa della carta e il suo completo mantenimento, come la stampa presso il punto di distribuzione, sembra essere al momento una delle migliori.
Modalità alternative per la fornitura del foglietto illustrativo stampato dei medicinali
Tre approcci promettenti sono:
- Stampa da parte di un professionista come il distributore/venditore di medicinali o l'operatore sanitario (ad esempio, presso una farmacia, un centro sanitario, una struttura di assistenza per pazienti o anziani)
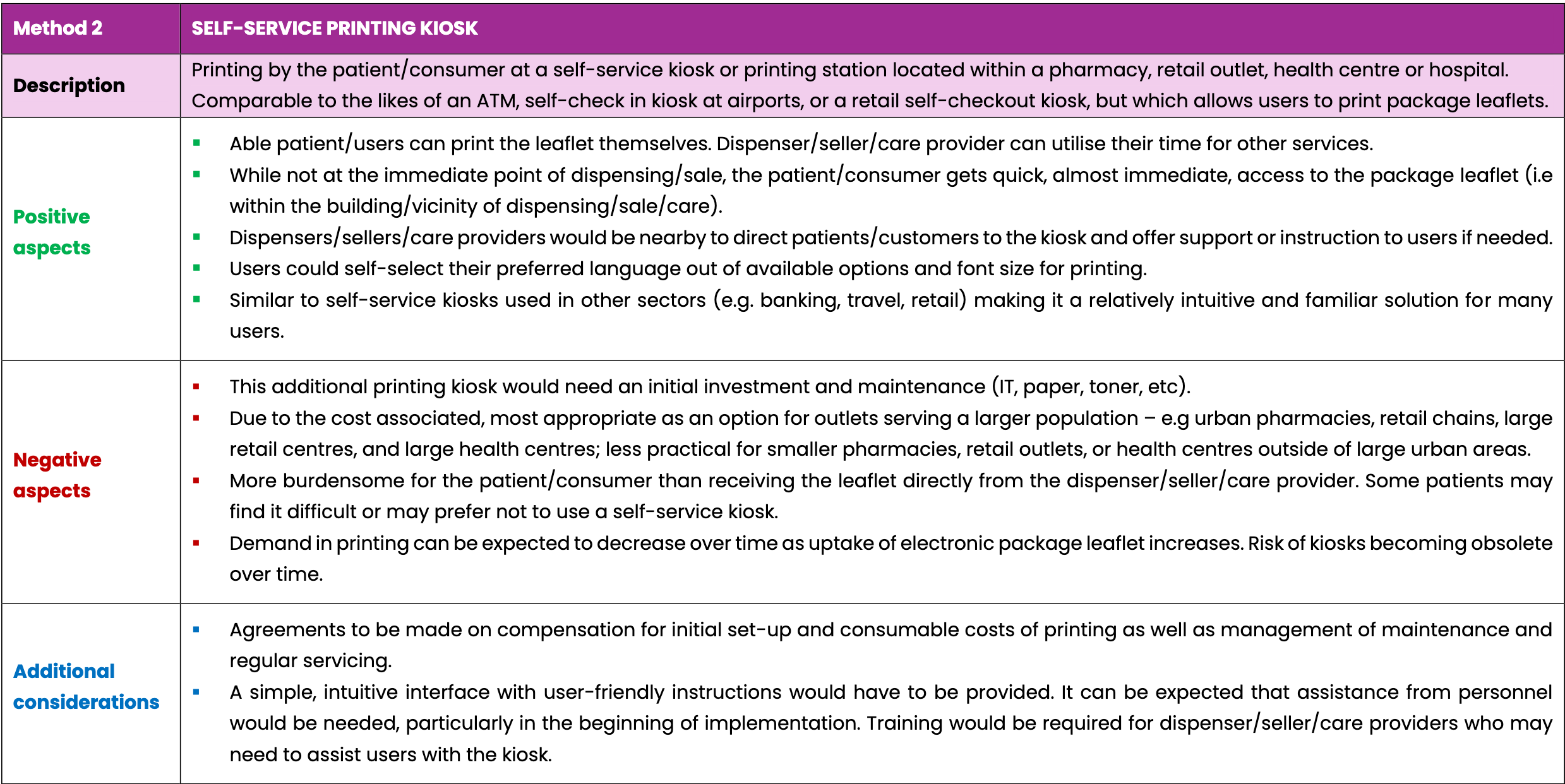
- Stampa da parte del paziente presso un chiosco self-service situato all'interno di una farmacia, un punto vendita al dettaglio, un centro sanitario o un ospedale, e
- Stampa da parte del paziente presso un chiosco self-service presso un centro di stampa comunitario in un luogo pubblico idoneo
Tutte e tre le opzioni prevedono l'utilizzo di tecnologie di scansione con codici a matrice di dati 2D o codici a barre lineari esistenti sulla confezione del medicinale. Ciò garantirà che venga sempre stampato il foglietto illustrativo corretto per il medicinale dispensato o venduto, evitando potenziali errori derivanti dalla ricerca manuale di un foglietto illustrativo specifico.
Altre possibili soluzioni prese in considerazione includono la consegna tramite corriere dei foglietti illustrativi al momento della prescrizione e la consegna di materiale stampato da parte del produttore.
Le tabelle seguenti confrontano tre possibili modi per fornire una copia stampata dei foglietti illustrativi a pazienti e consumatori di medicinali su richiesta. Le tre opzioni elencate non sono esaustive. Questo scenario considera uno scenario futuro in cui i foglietti illustrativi saranno forniti esclusivamente in formato elettronico e non saranno più necessari all'interno della confezione di ciascun medicinale.


Disclaimer
Questo post è un riassunto che evidenzia i punti principali sollevati da diverse associazioni di settore in relazione all'introduzione del foglietto illustrativo digitale (eLeaflet) per la salute e i medicinali. Il contenuto di questo post non riflette necessariamente la posizione di myHealthbox in relazione a questi argomenti.
Riferimenti
AESGP è l'Associazione dell'Industria Europea dei Prodotti di Automedicazione (AESGP), un'organizzazione no-profit che rappresenta i produttori di medicinali senza prescrizione medica, integratori alimentari e dispositivi medici di automedicazione in Europa, un settore noto anche come "prodotti di automedicazione" o "prodotti per la salute di consumo".
EFPIA è la Federazione Europea delle Industrie e delle Associazioni Farmaceutiche (EFPIA) e rappresenta l'industria biofarmaceutica che opera in Europa.
Medicines for Europe è nata oltre 20 anni fa come European Generic Medicines Association (EGA) con l'obiettivo di rappresentare l'industria emergente dei farmaci generici, per poi crescere fino a includere i farmaci biosimilari nel suo portafoglio. Medicines for Europe rappresenta le aziende farmaceutiche che forniscono la quota maggiore di medicinali in Europa ed è portavoce dei settori dei farmaci generici, biosimilari e a valore aggiunto.