Nesta primeira postagem, examinaremos a iniciativa da UE que explora a introdução de informações eletrônicas sobre o produto (ePI) para medicamentos humanos autorizados na UE. Também veremos como a solução eLeaflet do myHealthbox funciona em relação aos requisitos estabelecidos por esta iniciativa ePI da UE.
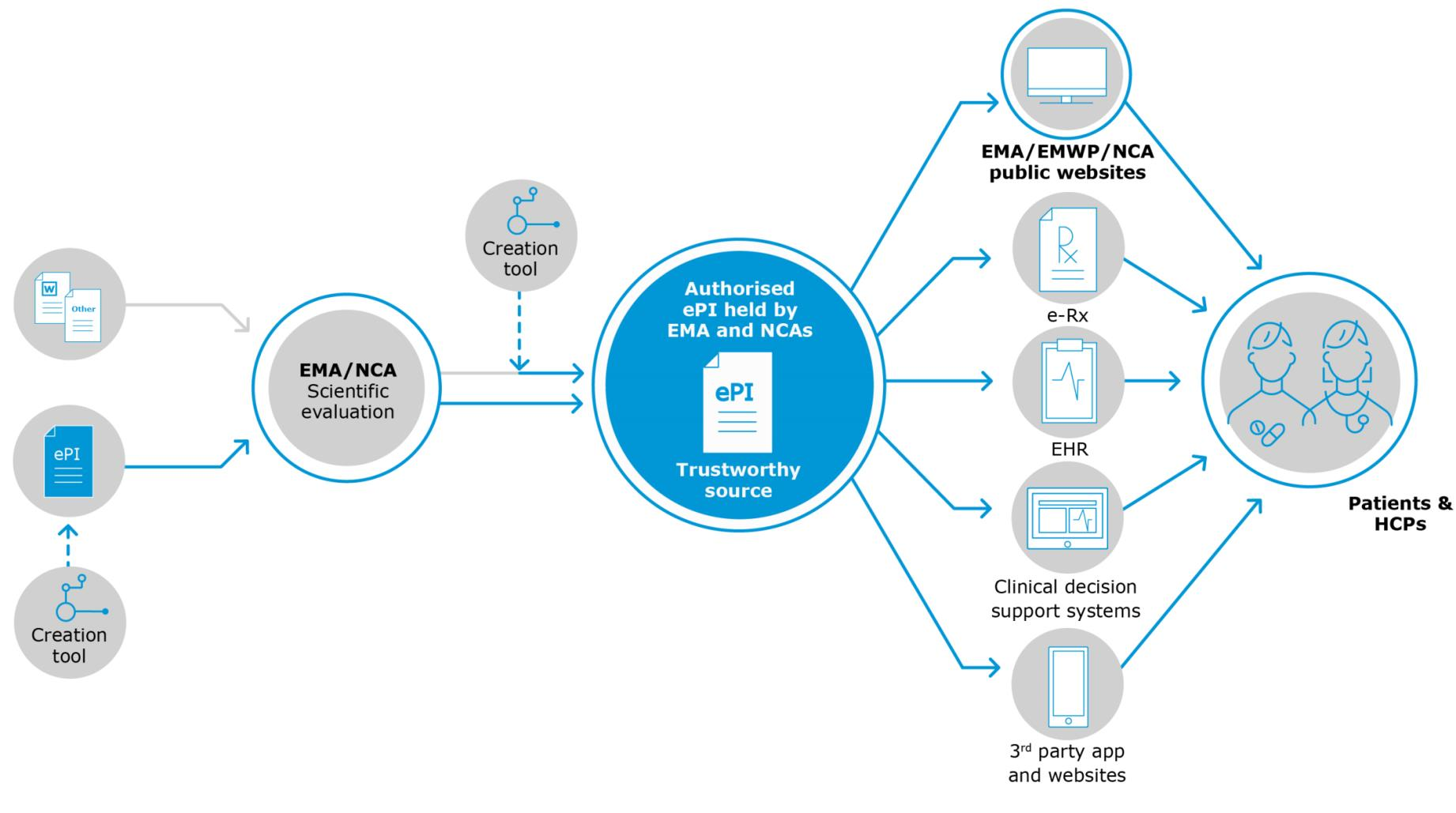
Especificamente, a Parte 1 desta série examinará o "status quo" para esta iniciativa, a justificativa para a introdução desta tecnologia e os recursos esperados de uma implementação ePI que foram divididos em 3 categorias:
- aqueles relacionados aos dados ePI este artigo;
- aqueles relacionados à experiência do usuário ePI (Parte 2 disponível aqui);
- potenciais funcionalidades futuras que podem ser adicionadas ao ePI assim que for estabelecido (Parte 3 disponível aqui).
O roteiro (até agora)
Março de 2017
- A Comissão Europeia (CE) publica o seu relatório sobre as lacunas atuais no resumo das características do medicamento (RCM) e no folheto informativo (PL) e como podem ser melhorados para melhor satisfazer as necessidades dos doentes e profissionais de saúde.
Novembro de 2017
- A Agência Europeia de Medicamentos (EMA) publica um plano de ação detalhando as ações necessárias para cumprir os objetivos definidos no relatório do CE. Uma das ações consiste em explorar a forma como o ePI pode facilitar o acesso dos cidadãos da UE às informações do PL e do RCM.
- A EMA lança um inquérito para obter informações das partes interessadas, a fim de mapear as iniciativas ePI em curso em da UE.
![]()
Julho de 2018
- Os chefes das agências de medicamentos (HMA) e representantes das autoridades nacionais competentes (NCAs), da indústria farmacêutica e das organizações de pacientes e profissionais de saúde se reúnem em Madrid para reunir as opiniões das principais partes interessadas sobre o ePI.
Setembro de 2018
- O Grupo de Trabalho dos Pacientes e Consumidores (PCWP) e o Grupo de Trabalho dos Profissionais de Saúde (HCPWP) da EMA são atualizados sobre o trabalho em andamento e os princípios básicos para o ePI na UE são discutidos na reunião de setembro.
Outubro de 2018
- As discussões em grupos virtuais são realizadas por representantes da Força-Tarefa Inter-Associações da indústria farmacêutica (IATF) e as NCAs da França, Islândia, Holanda, Noruega e Espanha para elaborar recursos e casos de uso para um padrão comum para ePI.
Novembro de 2018
- O esboço dos princípios-chave para ePI são discutidos em uma reunião do Grupo de Coordenação para Reconhecimento Mútuo e Procedimentos Descentralizados - Humanos (CMDh).
- EMA-HMA-EC workshop on ePI decorre nas instalações da EMA, em Londres, a 28 de novembro. Um grupo diversificado de partes interessadas, incluindo pacientes, HCPs, acadêmicos, organizações sem fins lucrativos e representantes da indústria farmacêutica participam do workshop.
Janeiro de 2019
- Um relatório, vídeo e apresentações do workshop são publicados. O principal resultado do workshop, o documento ‘Informações sobre produtos eletrônicos para medicamentos humanos na UE - Princípios-chave do projeto’, foi lançado para consulta pública de 6 meses.
Janeiro de 2020
- Um documento que descreve os princípios-chave para desenvolver o ePI foi publicado pela EMA, HMA e pela Comissão Europeia. A diretriz estabeleceu a base dos padrões técnicos comuns a serem usados para superar a questão da interoperabilidade. O impacto esperado também inclui a redução do tempo de trabalho e disponibilização de variações regulatórias. Este documento agora representa a orientação da EMA-HMA-EC sobre ePI e forma a base dos planos de implementação de acompanhamento para ePI. O documento é denominado: "Informações sobre produtos eletrônicos para medicamentos humanos na UE: princípios-chave"
As características
Dados
Dados abertos que podem ser reutilizados em outras ferramentas
Os dados ePI devem ser disponibilizados gratuitamente para utilização e reutilização, de modo a que se tornem um recurso para terceiros, como investigadores, promotores, organizações e empresas, bem como para autoridades fora da UE.
A solução eLeaflet da myHealthbox é baseada em padrões abertos e baseados na web. As informações estão disponíveis gratuitamente e podem ser distribuídas.
Link da embalagem do medicamento
O ePI deve estar acessível diretamente na embalagem do medicamento, por exemplo, digitalizando um código de barras na embalagem.
A solução eLeaflet de myHealthbox já suporta uma variedade de códigos disponíveis na embalagem, bem como pesquisas de texto com base em códigos de barras. As implementações mais comuns suportam um código QR que na maioria dos casos não requer um aplicativo ou leitor dedicado, mas pode ser lido rapidamente de qualquer smartphone.
EPI específico de lote
Algumas alterações em um medicamento, como uma alteração em um excipiente, podem significar que um ePI diferente seria válido para diferentes lotes de um medicamento. Por exemplo, lotes mais antigos de um medicamento que ainda estão "na prateleira" podem ter um ePI diferente dos lotes mais novos sendo liberados pelo fabricante. Portanto, deve ser possível vincular cada embalagem de medicamento em um determinado lote ao ePI correto e específico do lote.
A solução eLeaflet de myHealthbox já suporta este recurso, um eLeaflet pode ser vinculado a um produto específico ou a um lote específico de produtos (os lotes devem ser identificados por números únicos). Uma pesquisa pelo produto apresentará ao usuário uma lista de lotes em que cada lote pode ter informações diferentes do produto.
Histórico de atualizações de PI
O ePI deve suportar controle de versão, o que significa que deve ser possível acessar versões históricas do ePI e observar as mudanças que ocorreram ao longo do tempo.
A solução eLeaflet de myHealthbox já suporta este recurso que está disponível no motor de busca myHealthbox (apenas para usuários com uma licença completa) ou via APIs.
Segurança de dados
O conteúdo ePI deve ser seguro e protegido contra alterações não autorizadas.
A solução eLeaflet de myHealthbox implementa um protocolo muito rígido para garantir que os dados sejam empacotados de uma forma que não possam ser modificados.
A lista completa de recursos inclui:
- suporte para uma assinatura digital (soma de verificação) para assinar o conteúdo
- um procedimento de verificação de conteúdo / API
- suporte para um serviço de notário blockchain para implementar certificação e verificação de conteúdo.
Dados privados
Qualquer uso de ePI envolvendo a coleta de dados pessoais deve estar em conformidade com a legislação de proteção de dados para garantir que a privacidade do paciente seja mantida e que isso seja feito legalmente.
A solução eLeaflet de myHealthbox não pede nem usa nenhuma informação pessoal a menos que seja estritamente necessário e somente após consentimento explícito do usuário. Recursos que exigem entrada de dados pessoais como o "Lembrete de pílula" e a "Calculadora de dosagem" seguem todas as regulamentações de privacidade existentes em relação à coleta e uso de dados. Todos os dados analíticos são anônimos.
Mais informações sobre a solução eLeaflet do myHealthbox estão disponíveis no site do eLeaflet