In questo primo articolo esamineremo l'iniziativa dell'UE che esplora l'introduzione di informazioni elettroniche sul prodotto (ePI) per i medicinali per uso umano autorizzati nell'UE. Vedremo anche come si comporta la soluzione eLeaflet di myHealthbox rispetto ai requisiti stabiliti da questa iniziativa ePI della Comunità Europea.
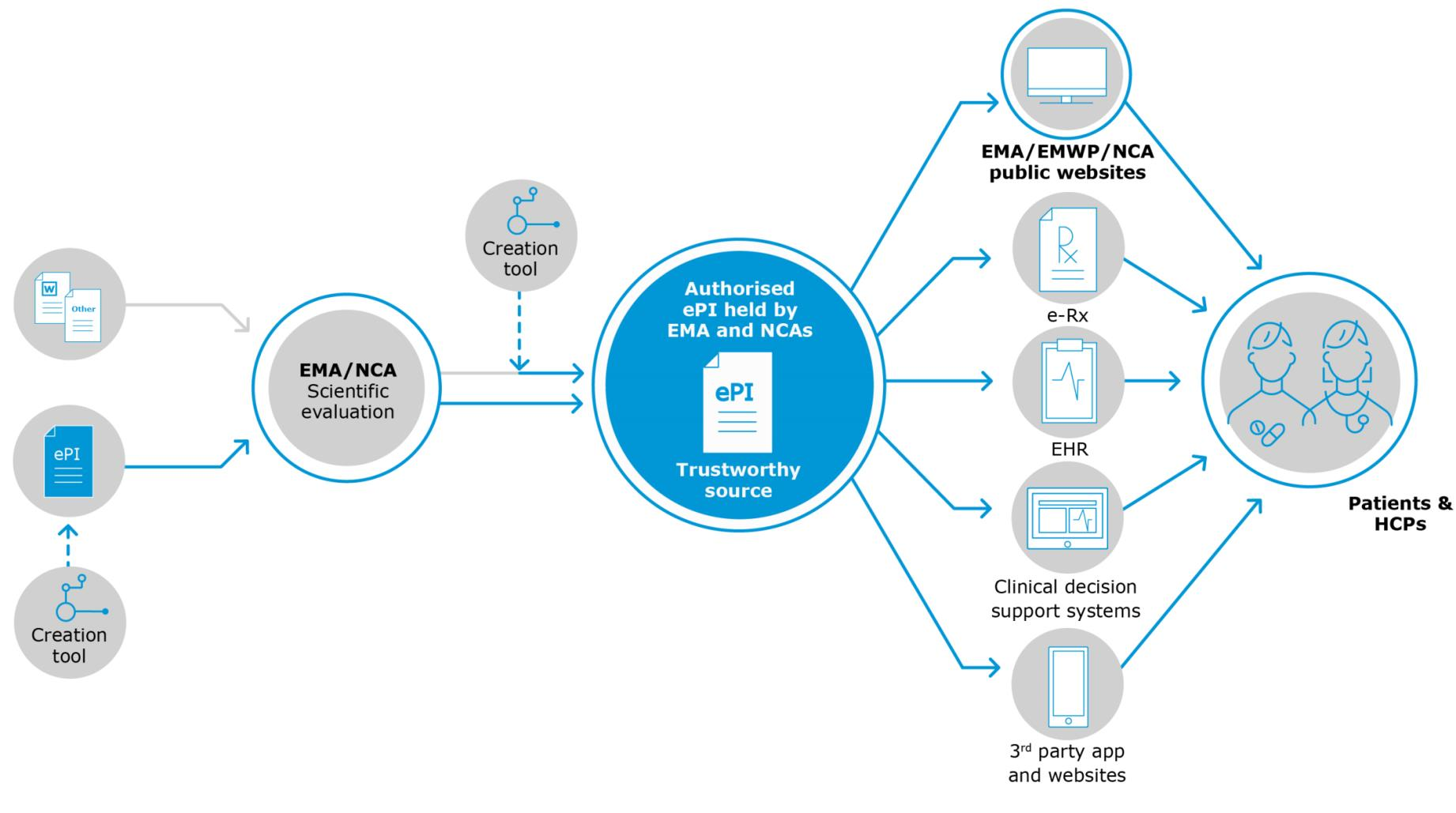
In particolare, la Parte 1 di questa serie esaminerà lo "status quo" di questa iniziativa, la logica per la sua introduzione e le caratteristiche previste da un'implementazione dell'ePI, queste sono state poi suddivise in 3 categorie principali:
- quella relativa ai dati dell'ePI (questo articolo);
- quella relativa all'esperienza utente nell'uso dell'ePI (Parte 2 disponibile qui);
- quella relativa alle funzionalità future che potrebbero essere aggiunte all'ePI una volta che questo ha preso piede come soluzione digitale (Parte 3 disponibile qui).
La roadmap (finora)
Marzo 2017
- La Commissione Europea (CE) pubblica il suo rapporto sulle attuali carenze nel riassunto delle caratteristiche del prodotto (RCP) e nel foglietto illustrativo (PL) e su come potrebbero essere migliorati per soddisfare meglio le esigenze dei pazienti e degli operatori sanitari.
Novembre 2017
- L'Agenzia europea per i medicinali (EMA) pubblica un [piano d'azione](https://www.ema.europa.eu/documents/other/european-medicines-agency-action-plan-related-european-commissions-recommendations-product_en. pdf) che dettaglia le azioni necessarie per raggiungere gli obiettivi fissati nella relazione della CE. Una delle azioni consiste nell'esplorare come l'EPI possa facilitare l'accesso dei cittadini dell'UE alle informazioni contenute nel PL e nell'RCP.
- L'EMA lancia un sondaggio per recepire informazioni dalle parti interessate al fine di mappare le iniziative ePI in corso nell' Unione Europea.
![]()
Luglio 2018
- I capi delle agenzie per i medicinali (HMA) e i rappresentanti delle autorità nazionali competenti (NCA), dell'industria farmaceutica e delle organizzazioni dei pazienti e degli operatori sanitari si incontrano a Madrid per raccogliere i punti di vista delle principali parti interessate sull'ePI.
Settembre 2018
- Il gruppo di lavoro dei pazienti e dei consumatori (PCWP) dell'EMA e il gruppo di lavoro dei professionisti sanitari (HCPWP) vengono aggiornati sul lavoro in corso e le bozze dei principi chiave per l'epi nell'UE sono discusse nel loro [incontro di settembre](https://www.ema .europa.eu/documenti/report/meeting-summary-ema-human-scientific-committees-working-party-pazienti-consumatori-organizzazioni-pcwp_en.pdf).
Ottobre 2018
- Le discussioni di gruppo virtuale sono tenute da rappresentanti della Task Force interassociativa dell'industria farmaceutica (IATF) e le ANC di Francia, Islanda, Paesi Bassi, Norvegia e Spagna per redigere caratteristiche e casi d'uso per uno standard comune per l'ePI.
Novembre 2018
- La bozza dei principi chiave per l'ePI viene discussa in una riunione del gruppo di coordinamento per il riconoscimento reciproco e le procedure decentralizzate - Umane (CMDh).
- Un seminario con EMA-HMA-EC sull' ePI si tiene presso la sede di EMA a Londra il 28 novembre. Al seminario partecipa un gruppo eterogeneo di parti interessate, inclusi pazienti, operatori sanitari, accademici, organizzazioni senza scopo di lucro e rappresentanti dell'industria farmaceutica.
Gennaio 2019
- Vengono pubblicati un report, un video e le presentazioni del workshop. Il principale risultato del seminario, il documento "Informazioni sui prodotti in formato elettronico per i medicinali per uso umano nell'UE - Bozza di principi chiave", è stato pubblicato per una consultazione pubblica di 6 mesi.
Gennaio 2020
- Un documento che descrive i principi chiave per sviluppare l'ePI è stato pubblicato da EMA, HMA e dalla Commissione Europea. La linea guida pone le basi degli standard tecnici comuni da utilizzare per superare il problema dell'interoperabilità. L'impatto previsto include anche un tempo ridotto per lavorare e rendere disponibili variazioni normative. Questo documento rappresenta ora la guida EMA-HMA-EC sull'ePI e costituisce la base dei piani di attuazione e di follow-up per l'ePI. Il documento si chiama: "Informazioni sul prodotto in formato elettronico per i medicinali per uso umano nell'UE: principi chiave"
Le caratteristiche
I dati
Dati aperti che possono essere riutilizzati in altre applicazioni
I dati dell'ePI dovrebbero essere liberamente disponibili per l'uso ed il riutilizzo in modo che diventino una risorsa per terze parti quali ricercatori, sviluppatori, organizzazioni e imprese, nonché autorità al di fuori dell'UE.
La soluzione eLeaflet di myHealthbox si basa su standard aperti, basati sul web. Le informazioni sono liberamente accessibili e distribuibili.
Collegato alla confezione della medicina
L'ePI dovrebbe essere accessibile direttamente dalla confezione del medicinale, ad esempio mediante la scansione di un codice a barre sulla confezione.
La soluzione eLeaflet di myHealthbox supporta già una varietà di codici disponibili sulla confezione, nonché ricerche di testo basate su codici a barre. Le implementazioni più comuni supportano un codice QR che nella maggior parte dei casi non richiede un'applicazione o un lettore dedicato ma può essere scansionato rapidamente da qualsiasi smartphone.
Supporto per lotti differenti
Alcune modifiche a un medicinale, come una modifica a un eccipiente, potrebbero significare che un ePI diverso sarebbe valido per diversi lotti di un medicinale. Ad esempio, i lotti più vecchi di un medicinale che sono ancora "sullo scaffale" potrebbero avere un ePI diverso rispetto ai lotti più recenti rilasciati dal produttore. Pertanto, dovrebbe essere possibile collegare ogni confezione di medicinale in un particolare lotto all'ePI corretto e specifico per quel lotto.
La soluzione eLeaflet di myHealthbox supporta già questa funzionalità, un eLeaflet può essere collegato ad un prodotto specifico o ad uno specifico lotto di prodotti (i lotti devono essere identificati da numeri univoci). Una ricerca per il prodotto presenterà all'utente un elenco di lotti in cui ogni lotto può avere informazioni differenti sul prodotto.
Storico degli aggiornamenti di un ePI
Un ePI dovrebbe supportare il controllo delle versioni, il che significa che dovrebbe essere possibile accedere alle versioni storiche di ePI e annotare i cambiamenti avvenuti nel tempo.
La soluzione eLeaflet di myHealthbox supporta già questa funzione, disponibile sul motore di ricerca myHealthbox (solo per utenti con licenza completa) o tramite API.
La sicurezza dei dati
Il contenuto dell'ePI dovrebbe essere sicuro e protetto da modifiche non autorizzate.
La soluzione eLeaflet di myHealthbox implementa un protocollo molto rigoroso per garantire che i dati siano gestiti in modo da non poter essere modificati.
L'elenco completo delle funzionalità include:
- supporto per una firma digitale per firmare il contenuto
- una procedura di verifica del contenuto tramite API
- supporto per un servizio notarile blockchain per implementare la certificazione e la verifica dei contenuti.
Privacy dei dati
Qualsiasi utilizzo di ePI che comporti la raccolta di dati personali deve essere conforme alla legislazione sulla protezione dei dati per garantire che la privacy del paziente sia rispettata e che ciò avvenga legalmente.
La soluzione eLeaflet di myHealthbox non richiede né utilizza alcuna informazione personale a meno che non sia strettamente necessario e solo previo consenso esplicito dell'utente. Funzionalità che richiedono l'inserimento di dati personali come "Pill Reminder" e "Dosage Calculator" seguono tutte le normative sulla privacy esistenti per quanto riguarda la raccolta e l'utilizzo dei dati. Tutti i dati raccolti e manipolati dalle funzionalità di "data analytics" sono resi anonimi.
Ulteriori informazioni sulla soluzione eLeaflet di myHealthbox sono disponibili sul sito web eLeaflet