En este primer artículo, analizaremos la iniciativa de la UE que explora la introducción de una información de producto electrónica (ePI) para medicamentos humanos autorizados en la UE. También veremos cómo funciona la solución eLeaflet de myHealthbox frente a los requisitos establecidos por esta iniciativa ePI de la UE.
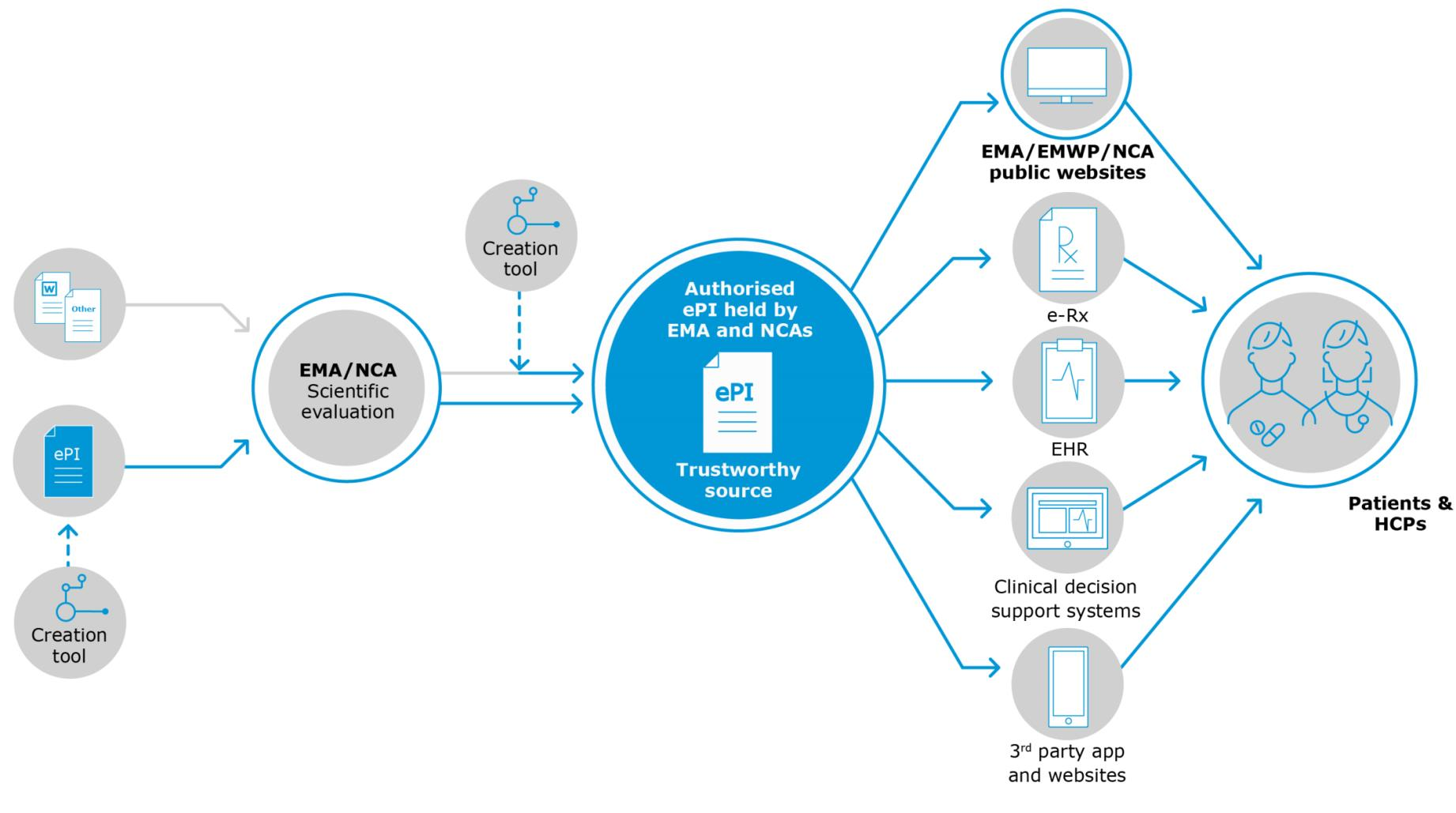
Específicamente, la Parte 1 de esta serie analizará el "status quo" de esta iniciativa, la justificación para introducir esta tecnología y las características que se esperan de una implementación de ePI que se han dividido en 3 categorías:
- los relacionados con los datos de ePI este artículo;
- los relacionados con la experiencia del usuario, disponible aquí);
- los relacionados con los posibles funcionalidades futuras que podrían agregarse a ePI una vez que se establezca, la Parte 3 está disponible aquí.
La hoja de ruta (hasta ahora)
Marzo de 2017
- La Comisión Europea (CE) publica su informe sobre las deficiencias actuales en el resumen de las características del producto (RCP) y el prospecto (PL) y cómo podrían mejorarse para satisfacer mejor las necesidades de los pacientes y los profesionales sanitarios.
Noviembre de 2017
- La Agencia Europea de Medicamentos (EMA) publica un plan de acción detallando las acciones necesarias para alcanzar los objetivos establecidos en el informe de la CE. Una de las acciones es explorar cómo ePI podría facilitar el acceso de los ciudadanos de la UE a la información contenida en el PL y el RCP.
- La EMA lanza una encuesta buscando información de las partes interesadas con el fin de mapear las iniciativas de ePI en curso en Los Estados unidos.
![]()
Julio de 2018
- Los Jefes de Agencias de Medicamentos (HMA) y representantes de las autoridades nacionales competentes (ANC), la industria farmacéutica y las organizaciones de pacientes y HCP se reúnen en Madrid para recopilar las opiniones de las partes interesadas clave sobre la ePI.
Septiembre de 2018
- El Grupo de Trabajo de Pacientes y Consumidores (PCWP) y el Grupo de Trabajo de Profesionales Sanitarios (HCPWP) de la EMA están actualizados sobre el trabajo en curso y los borradores de principios clave para la ePI en la UE se debaten en su reunión de septiembre.
Octubre de 2018
- Los representantes del Grupo de trabajo entre asociaciones de la industria farmacéutica llevan a cabo debates de grupo virtual. (IATF) y las ANC de Francia, Islandia, los Países Bajos, Noruega y España para redactar características y casos de uso para un estándar común para ePI.
Noviembre de 2018
- El borrador de principios clave para ePI se discute en una reunión del Grupo de Coordinación de Reconocimiento Mutuo y Procedimientos Descentralizados - Humanos (CMDh).
- EMA-HMA-EC taller on ePI tendrá lugar en las instalaciones de la EMA en Londres el 28 de noviembre. Asiste al taller un grupo diverso de partes interesadas, incluidos pacientes, profesionales sanitarios, académicos, organizaciones sin fines de lucro y representantes de la industria farmacéutica.
Enero de 2019
- Se publica un informe, video y presentaciones del taller. El principal resultado del taller, el documento "Información electrónica sobre productos para medicamentos de uso humano en la UE - Borrador de principios clave", se publica para una consulta pública de seis meses.
Enero de 2020
- La EMA, HMA y la Comisión Europea han publicado un documento que describe los principios clave para desarrollar el ePI. La directriz sienta las bases de las normas técnicas comunes que se utilizarán para superar el problema de la interoperabilidad. El impacto esperado también incluye una reducción del tiempo de trabajo y la puesta a disposición de variaciones regulatorias. Este documento ahora representa la guía de EMA-HMA-EC sobre ePI y forma la base de los planes de implementación de seguimiento para ePI. El documento se llama: "Información de productos electrónicos para medicamentos humanos en la UE: principios clave "
Las características
Los datos
Datos abiertos que se pueden reutilizar en otras herramientas
Los datos de ePI deben estar disponibles gratuitamente para su uso y reutilización, de modo que se conviertan en un recurso para terceros, como investigadores, desarrolladores, organizaciones y empresas, así como para autoridades fuera de la UE.
La solución eLeaflet de myHealthbox se basa en estándares abiertos, basados en la web. La información está disponible y distribuida gratuitamente.
Vinculado desde el paquete de medicamentos
El ePI debe ser accesible directamente desde el paquete del medicamento, por ejemplo, escaneando un código de barras en el paquete.
La solución eLeaflet de myHealthbox ya admite una variedad de códigos disponibles en el empaque, así como búsquedas de texto basadas en códigos de barras. Las implementaciones más comunes admiten un código QR que, en la mayoría de los casos, no requiere una aplicación o un lector dedicados, pero se puede escanear rápidamente desde cualquier teléfono inteligente.
EPI específico de lote
Algunos cambios en un medicamento, como un cambio en un excipiente, podrían significar que un ePI diferente sería válido para diferentes lotes de un medicamento. Por ejemplo, los lotes más antiguos de un medicamento que todavía están "en el estante" podrían tener un ePI diferente al de los lotes más nuevos que lanza el fabricante. Por lo tanto, debería ser posible vincular cada paquete de medicamento en un lote en particular con el ePI correcto y específico del lote.
La solución de eLeaflet de myHealthbox ya es compatible con esta función; un eLeaflet se puede vincular a un producto específico oa un lote específico de productos (los lotes deben identificarse con números únicos). Una búsqueda del producto presentará al usuario una lista de lotes donde cada lote puede tener información de producto diferente.
Historial de actualizaciones de PI
El ePI debería admitir el control de versiones, lo que significa que debería ser posible acceder a versiones históricas del ePI y anotar los cambios que se han producido a lo largo del tiempo.
La solución eLeaflet de myHealthbox ya es compatible con esta función, que está disponible en el motor de búsqueda myHealthbox (solo para usuarios con una licencia completa) o mediante API.
Seguridad de datos
El contenido de ePI debe ser seguro y protegido contra cambios no autorizados.
La solución eLeaflet de myHealthbox implementa un protocolo muy estricto para garantizar que los datos se empaqueten de una manera que no se pueda modificar.
La lista completa de características incluye:
- soporte para una firma digital (suma de verificación) para firmar contenido
- un procedimiento de verificación de contenido / API
- Soporte para un servicio de notario blockchain para implementar la certificación y verificación de contenido.
Privacidad de datos
Cualquier uso de ePI que implique la recopilación de datos personales debe cumplir con la legislación de protección de datos para garantizar que se respete la privacidad del paciente y que esto se haga legalmente.
La solución eLeaflet de myHealthbox no solicita ni utiliza ninguna información personal a menos que sea estrictamente necesario y solo después del consentimiento explícito del usuario. Las funciones que requieren la entrada de datos personales como el "Recordatorio de la píldora" y la "Calculadora de dosis" siguen todas las regulaciones de privacidad existentes con respecto a la recopilación y el uso de datos. Todos los datos analíticos se anonimizan.
Más información sobre la solución eLeaflet de myHealthbox está disponible en el sitio web eLeaflet