In diesem ersten Beitrag werden wir uns mit der EU-Initiative befassen, die die Einführung einer elektronischen Produktinformation (ePI) für in der EU zugelassene Humanarzneimittel untersucht. Wir werden auch untersuchen, wie sich die eLeaflet-Lösung für myHealthbox gegen die Anforderungen dieser EU-ePI-Initiative verhält.
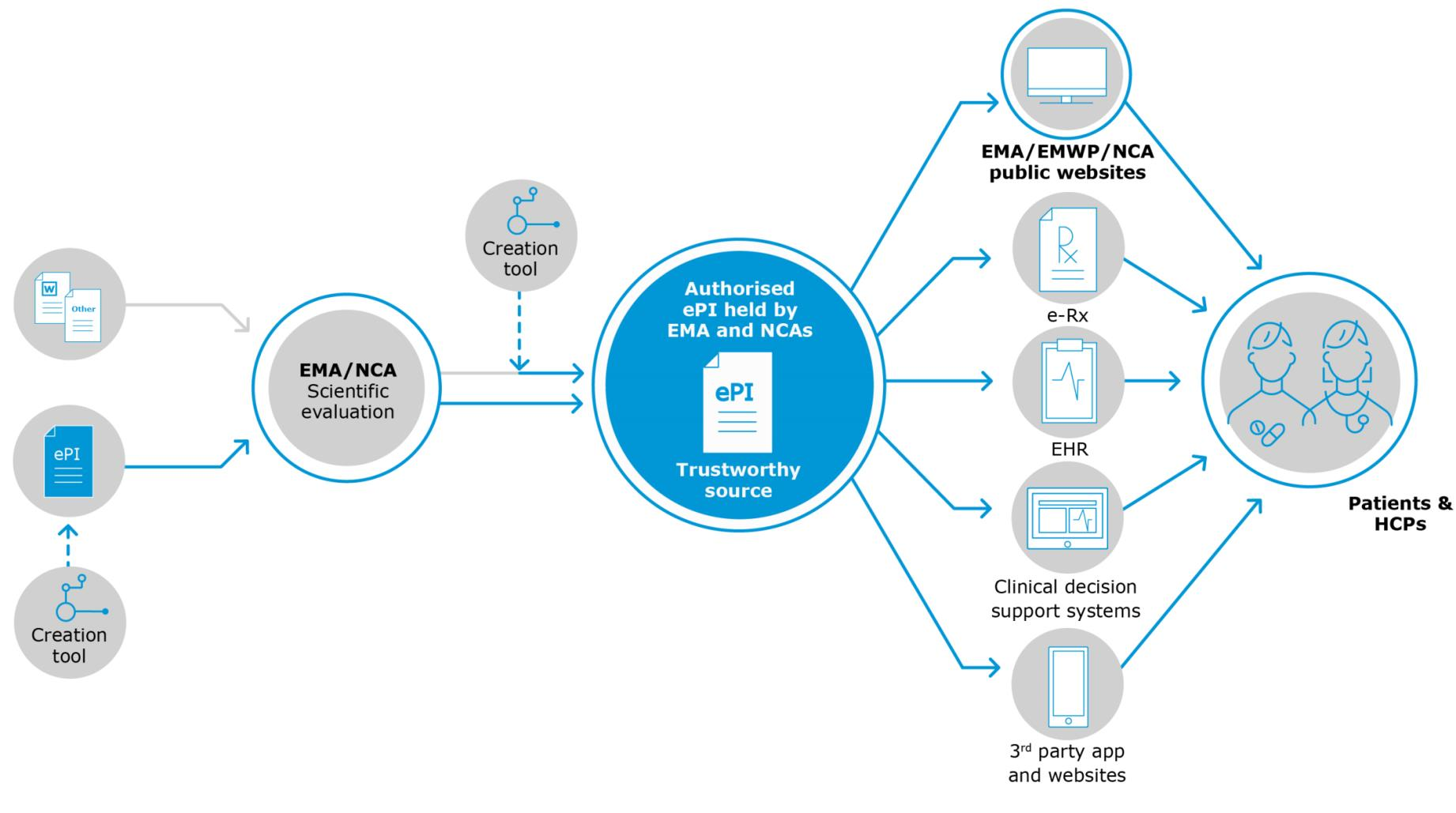
In Teil 1 dieser Reihe werden insbesondere der "Status quo" für diese Initiative, die Gründe für die Einführung dieser Technologie und die von einer ePI-Implementierung erwarteten Funktionen behandelt, die in drei Kategorien unterteilt wurden:
- diejenigen, die sich auf ePI-Daten beziehen dieser Artikel;
- diejenigen, die sich auf die ePI-Benutzererfahrung beziehen (Teil 2 verfügbar hier);
- potenzielle zukünftige Funktionen, die nach ihrer Einrichtung zu ePI hinzugefügt werden könnten (Teil 3 verfügbar hier).
Die Roadmap (bisher)
März 2017
- Die Europäische Kommission (EG) veröffentlicht ihren Bericht über aktuelle Mängel in der Zusammenfassung der Produkteigenschaften (SmPC) und der Packungsbeilage (PL) und darüber, wie sie verbessert werden könnten, um den Bedürfnissen von Patienten und HCPs besser gerecht zu werden.
November 2017
- Die Europäische Arzneimittel-Agentur (EMA) veröffentlicht einen Aktionsplan Einzelheiten zu den Maßnahmen, die zur Erreichung der im EG-Bericht festgelegten Ziele erforderlich sind. Eine der Maßnahmen besteht darin, zu untersuchen, wie ePI den Zugang der EU-Bürger zu den Informationen in PL und SmPC erleichtern könnte.
- EMA startet eine Umfrage, in der Informationen von Interessengruppen eingeholt werden, um die laufenden ePI-Initiativen abzubilden die EU.
![]()
Juli 2018
- Die Leiter der Arzneimittelagenturen (HMA) und Vertreter der zuständigen nationalen Behörden (NCAs), der Pharmaindustrie sowie der Patienten- und HCP-Organisationen treffen sich in Madrid, um die Ansichten der wichtigsten Interessengruppen zu ePI zu sammeln.
September 2018
- Die EMA-Arbeitsgruppe für Patienten und Verbraucher (PCWP) und die Arbeitsgruppe für Angehörige der Gesundheitsberufe (HCPWP) werden über die laufenden Arbeiten informiert, und die Entwürfe der wichtigsten Grundsätze für ePI in der EU werden auf ihrer September-Sitzung erörtert..
Oktober 2018
- Virtuelle Gruppendiskussionen werden von Vertretern der Inter-Association Task Force der Pharmaindustrie abgehalten (IATF) und die NCAs von Frankreich, Island, den Niederlanden, Norwegen und Spanien, um Merkmale und Anwendungsfälle für einen gemeinsamen Standard für ePI zu entwerfen.
November 2018
- Der Entwurf der wichtigsten Grundsätze für ePI wird auf einer Sitzung der Koordinierungsgruppe für gegenseitige Anerkennung und dezentrale Verfahren - Mensch (CMDh) erörtert.
- EMA-HMA-EC Workshop zu ePI findet am 28. November in den Räumlichkeiten der EMA in London statt. Eine vielfältige Gruppe von Interessengruppen, darunter Patienten, HCPs, Wissenschaftler, gemeinnützige Organisationen und Vertreter der Pharmaindustrie, nehmen an dem Workshop teil.
Januar 2019
- Ein Bericht, ein Video und Präsentationen des Workshops werden veröffentlicht. Das Hauptergebnis des Workshops, das Dokument „Elektronische Produktinformationen für Humanarzneimittel in der EU - Entwurf der wichtigsten Grundsätze“, wird für eine sechsmonatige öffentliche Konsultation freigegeben.
Januar 2020
- Ein Dokument, das die wichtigsten Grundsätze für die Entwicklung des ePI beschreibt, wurde von EMA, HMA und der Europäischen Kommission veröffentlicht. Die Richtlinie legte die Grundlage für die gemeinsamen technischen Standards zur Überwindung des Problems der Interoperabilität. Zu den erwarteten Auswirkungen gehört auch eine kürzere Arbeitszeit und die Bereitstellung von regulatorischen Abweichungen. Dieses Dokument stellt nun die EMA-HMA-EC-Leitlinien zu ePI dar und bildet die Grundlage für Follow-up-Implementierungspläne für ePI. Das Dokument heißt: "Elektronische Produktinformationen für Humanarzneimittel in der EU: Schlüsselprinzipien"
Die Funktionen
ePI-Daten
Öffnen Sie Daten, die in anderen Tools wiederverwendet werden können
ePI-Daten sollten zur Verwendung und Wiederverwendung frei verfügbar sein, damit sie zu einer Ressource für Dritte wie Forscher, Entwickler, Organisationen und Unternehmen sowie Behörden außerhalb der EU werden.
Die eLeaflet-Lösung von myHealthbox basiert auf offenen, webbasierten Standards. Informationen sind frei verfügbar und verteilbar.
Aus dem Medizinpaket verknüpft
ePI sollte direkt von der Arzneimittelverpackung aus zugänglich sein, z. B. durch Scannen eines Barcodes auf der Verpackung.
Die eLeaflet-Lösung von myHealthbox unterstützt bereits eine Vielzahl von Codes, die auf Verpackungen verfügbar sind, sowie eine auf Barcodes basierende Textsuche. Die gängigsten Implementierungen unterstützen einen QR-Code, für den in den meisten Fällen keine spezielle Anwendung oder ein Lesegerät erforderlich ist, der jedoch von jedem Smartphone aus schnell eingescannt werden kann.
Chargenspezifischer ePI
Einige Änderungen an einem Arzneimittel, wie z. B. eine Änderung an einem Hilfsstoff, können bedeuten, dass ein anderer ePI für verschiedene Chargen eines Arzneimittels gültig ist. Beispielsweise können ältere Chargen eines Arzneimittels, die sich noch im Regal befinden, einen anderen ePI aufweisen als neuere Chargen, die vom Hersteller freigegeben werden. Daher sollte es möglich sein, jede Arzneimittelpackung in einer bestimmten Charge mit dem richtigen chargenspezifischen ePI zu verknüpfen.
Die eLeaflet-Lösung von myHealthbox unterstützt diese Funktion bereits. Ein eLeaflet kann mit einem bestimmten Produkt oder einer bestimmten Produktcharge verknüpft werden (Chargen müssen durch eindeutige Nummern gekennzeichnet sein). Bei einer Suche nach dem Produkt wird dem Benutzer eine Liste von Chargen angezeigt, in denen jede Charge unterschiedliche Produktinformationen enthalten kann.
Verlauf der PI-Updates
ePI sollte die Versionierung unterstützen, dh es sollte möglich sein, auf historische Versionen des ePI zuzugreifen und die im Laufe der Zeit vorgenommenen Änderungen zu notieren.
Die eLeaflet-Lösung von myHealthbox unterstützt diese Funktion bereits, die in der myHealthbox-Suchmaschine (nur für Benutzer mit einer vollständigen Lizenz) oder über APIs verfügbar ist.
Datensicherheit
ePI-Inhalte sollten sicher und vor unbefugten Änderungen geschützt sein.
Die eLeaflet-Lösung von myHealthbox implementiert ein sehr strenges Protokoll, um sicherzustellen, dass Daten auf eine Weise gepackt werden, die nicht geändert werden kann.
Die vollständige Liste der Funktionen umfasst:
- Unterstützung für eine digitale Signatur (Prüfsumme) zum Signieren von Inhalten
- ein Inhaltsüberprüfungsverfahren / eine API
- Unterstützung für einen Blockchain-Notariatsdienst zur Implementierung der Zertifizierung und Überprüfung von Inhalten.
Datenprivatsphäre
Jede Verwendung von ePI, bei der personenbezogene Daten erhoben werden, sollte den Datenschutzbestimmungen entsprechen, um sicherzustellen, dass die Privatsphäre der Patienten gewahrt bleibt und dies rechtmäßig erfolgt.
Die eLeaflet-Lösung von myHealthbox fragt und verwendet keine persönlichen Informationen, es sei denn, dies ist unbedingt erforderlich und nur nach ausdrücklicher Zustimmung des Benutzers. Funktionen, die die Eingabe personenbezogener Daten erfordern, wie die "Pillenerinnerung" und der "Dosierungsrechner", befolgen alle bestehenden Datenschutzbestimmungen in Bezug auf die Datenerfassung und -nutzung. Alle Analysedaten sind anonymisiert.
Weitere Informationen zur eLeaflet-Lösung von myHealthbox finden Sie auf der eLeaflet-Website.