La route vers l'ePI (c'est-à-dire les informations électroniques sur les produits) - Partie 1
Données
Dans ce premier article, nous examinerons l'initiative de l'UE explorant l'introduction d'une information électronique sur les produits (IPE) pour les médicaments à usage humain autorisés dans l'UE. Nous examinerons également les performances de la solution eLeaflet de myHealthbox par rapport aux exigences définies par cette initiative de l'UE ePI.
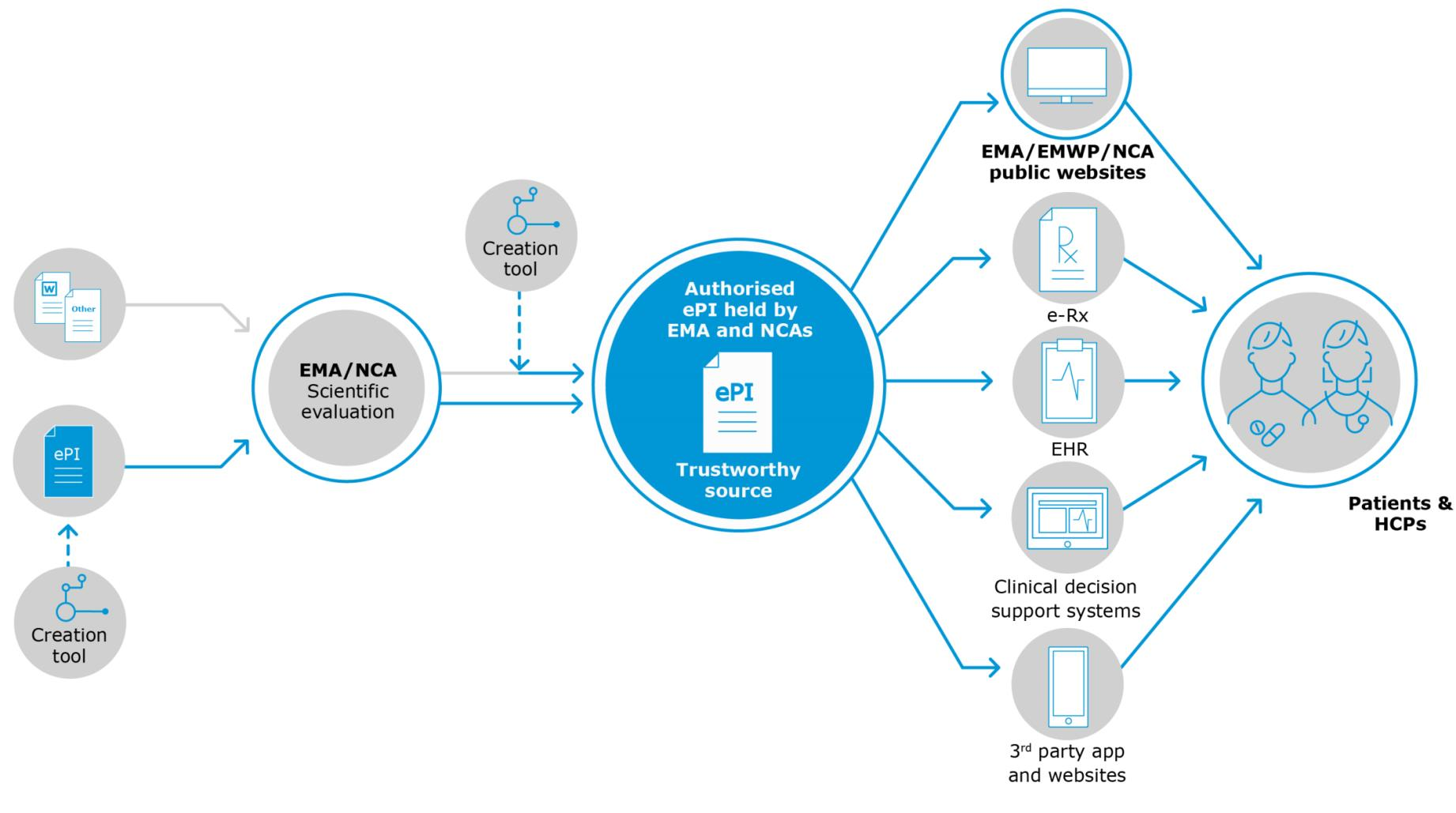
Plus précisément, la première partie de cette série examinera le «statu quo» de cette initiative, la justification de l'introduction de cette technologie et les caractéristiques attendues d'une mise en œuvre du PEV qui ont été divisées en 3 catégories:
- ceux relatifs aux données ePI (cet article);
- ceux relatifs à l'expérience utilisateur d'ePI (partie 2 disponible ici);
- futures fonctionnalités potentielles qui pourraient être ajoutées à ePI une fois qu'il sera établi (partie 3 disponible ici).
La feuille de route (jusqu'à présent)
Mars 2017
- La Commission européenne (CE) publie son rapport sur les lacunes actuelles dans le résumé des caractéristiques du produit (RCP) et la notice (PL) et sur la manière dont ils pourraient être améliorés afin de mieux répondre aux besoins des patients et des professionnels de la santé.
Novembre 2017
- L'Agence européenne des médicaments (EMA) publie un plan d'action détaillant les actions nécessaires pour atteindre les objectifs définis dans le rapport de la CE. L'une des actions consiste à explorer comment l'IPE pourrait faciliter l'accès des citoyens de l'UE aux informations contenues dans le PL et le SmPC.
- L'EMA lance une enquête recherchant des informations auprès des parties prenantes afin de cartographier les initiatives du PEV en cours l’UE.
![]()
Juillet 2018
- Les responsables des agences des médicaments (HMA) et les représentants des autorités nationales compétentes (ANC), de l'industrie pharmaceutique et des organisations de patients et de professionnels de la santé se réunissent à Madrid pour recueillir les points de vue des principales parties prenantes sur l'IPE.
Septembre 2018
- Le groupe de travail patients et consommateurs de l'EMA (PCWP) et le groupe de travail des professionnels de la santé (HCPWP) sont mis à jour sur les travaux en cours et les projets de principes clés pour l'IPE dans l'UE sont discutés lors de leur réunion de septembre.
Octobre 2018
- Des groupes de discussion virtuels sont organisés par des représentants du groupe de travail inter-associations de l'industrie pharmaceutique (IATF) et les ANC de France, d'Islande, des Pays-Bas, de Norvège et d'Espagne pour rédiger des caractéristiques et des cas d'utilisation pour une norme commune pour le PEV.
Novembre 2018
- Le projet de principes clés pour l'IPE est discuté lors d'une réunion du Groupe de coordination pour la reconnaissance mutuelle et les procédures décentralisées - Humain (CMDh).
- EMA-HMA-EC atelier on ePI a lieu dans les locaux de l'EMA à Londres le 28 novembre. Un groupe diversifié d'intervenants, y compris des patients, des professionnels de la santé, des universitaires, des organisations à but non lucratif et des représentants de l'industrie pharmaceutique assistent à l'atelier.
Janvier 2019
- Un rapport, une vidéo et des présentations de l'atelier sont publiés. Le principal résultat de l’atelier, le document «Information électronique sur les produits pour les médicaments à usage humain dans l’UE - Projet de principes clés», est publié pour une consultation publique de 6 mois.
Janvier 2020
- Un document décrivant les principes clés pour développer l'IPE a été publié par l'EMA, la HMA et la Commission européenne. La directive a jeté les bases des normes techniques communes à utiliser pour surmonter le problème de l'interopérabilité. L'impact attendu comprend également une réduction du temps de travail et la mise à disposition des variations réglementaires. Ce document représente désormais les orientations de l'EMA-HMA-EC sur l'IPE et constitue la base des plans de mise en œuvre de suivi pour l'IPE. Le document est intitulé: "Informations électroniques sur les médicaments à usage humain dans l'UE: principes clés".
Les caractéristiques
Données ePI
Des données ouvertes pouvant être réutilisées dans d'autres outils
Les données de l'IPE devraient être librement disponibles pour être utilisées et réutilisées afin qu'elles deviennent une ressource pour des tiers, tels que des chercheurs, des développeurs, des organisations et des entreprises, ainsi que pour des autorités extérieures à l'UE.
La solution eLeaflet de myHealthbox est basée sur des normes ouvertes basées sur le Web. Les informations sont librement disponibles et distribuables.
Lié à partir du package de médicaments
L'ePI doit être accessible directement à partir de l'emballage du médicament, par exemple en scannant un code-barres sur l'emballage.
La solution eLeaflet de myHealthbox prend déjà en charge une variété de codes disponibles sur les emballages ainsi que des recherches de texte basées sur des codes-barres. Les implémentations les plus courantes prennent en charge un code QR qui, dans la plupart des cas, ne nécessite pas d'application ou de lecteur dédié, mais peut être numérisé rapidement à partir de n'importe quel smartphone.
EPI spécifique au lot
Certaines modifications apportées à un médicament, telles que la modification d'un excipient, pourraient signifier qu'un IPE différent serait valable pour différents lots d'un médicament. Par exemple, des lots plus anciens d'un médicament qui sont toujours «sur les étagères» peuvent avoir un IPE différent de celui des lots plus récents mis sur le marché par le fabricant. Par conséquent, il devrait être possible de lier chaque emballage de médicament dans un lot particulier à l'IPE correct et spécifique au lot.
La solution eLeaflet de myHealthbox prend déjà en charge cette fonctionnalité, un eLeaflet peut être lié à un produit spécifique ou à un lot de produits spécifique (les lots doivent être identifiés par des numéros uniques). Une recherche du produit présentera à l'utilisateur une liste de lots où chaque lot peut avoir des informations produit différentes.
Historique des mises à jour PI
ePI devrait prendre en charge la gestion des versions, ce qui signifie qu'il devrait être possible d'accéder aux versions historiques de l'IPE et de noter les changements qui ont eu lieu au fil du temps.
La solution eLeaflet de myHealthbox prend déjà en charge cette fonctionnalité qui est disponible sur le moteur de recherche myHealthbox (uniquement pour les utilisateurs disposant d'une licence complète) ou via des API.
Sécurité des données
Le contenu ePI doit être sécurisé et protégé contre les modifications non autorisées.
La solution eLeaflet de myHealthbox implémente un protocole très strict pour garantir que les données sont conditionnées de manière non modifiable.
La liste complète des fonctionnalités comprend:
- prise en charge d'une signature numérique (somme de contrôle) pour signer le contenu
- une procédure de vérification de contenu / API
- Prise en charge d'un service de notaire blockchain pour implémenter la certification et la vérification du contenu.
La confidentialité des données
Toute utilisation d'ePI impliquant la collecte de données personnelles doit être conforme à la législation sur la protection des données afin de garantir que la vie privée des patients est respectée et que cela est fait légalement.
La solution eLeaflet de myHealthbox ne demande ni n'utilise aucune information personnelle à moins que cela ne soit strictement nécessaire et uniquement après le consentement explicite de l'utilisateur. Les fonctionnalités qui nécessitent la saisie de données personnelles telles que le «rappel de pilule» et le «calculateur de dosage» suivent toutes les réglementations en vigueur en matière de confidentialité en ce qui concerne la collecte et l'utilisation des données. Toutes les données analytiques sont anonymisées.
Plus d'informations sur la solution eLeaflet de myHealthbox sont disponibles sur le site Web eLeaflet