Elektronische Gebrauchsanweisungen und patientennahe Tests
Eine verpasste Chance in der EU-Regulierung
Die digitale Transformation des Gesundheitswesens schreitet in ganz Europa rasant voran. Von elektronischen Patientenakten bis hin zu vernetzten Medizinprodukten verändern digitale Werkzeuge die Patientenversorgung grundlegend. Ein wichtiger, aber oft übersehener Aspekt dieser Transformation ist die Bereitstellung von Gebrauchsanweisungen für medizinisches Fachpersonal.
Elektronische Gebrauchsanweisungen (eIFUs) sind für viele Medizinprodukte im professionellen Einsatz bereits weit verbreitet. Patientennahe Testgeräte stellen jedoch nach geltendem EU-Recht noch eine Ausnahme dar. Dies führt zu einer regulatorischen Inkonsistenz, die Digitalisierung, Nachhaltigkeit und Benutzerfreundlichkeit in einem schnell wachsenden Bereich der Diagnostik einschränkt.
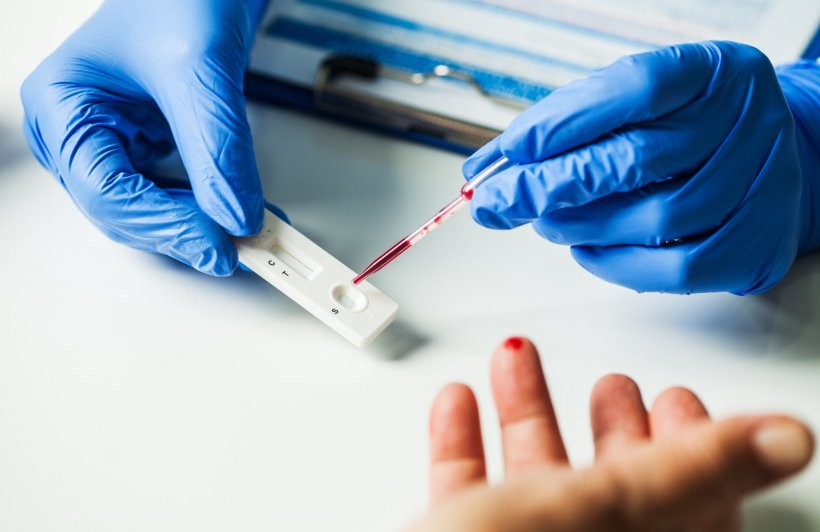
Was ist patientennahes Testen?
Patientennahe Testgeräte (NPT), auch bekannt als Point-of-Care-Testing (POCT), sind tragbare Geräte, die von medizinischem Fachpersonal (oder Patienten) außerhalb von Laboren für schnelle Diagnosetests eingesetzt werden. Sie liefern rasche Ergebnisse für sofortige Behandlungsentscheidungen, beispielsweise in Notaufnahmen, Kliniken oder zu Hause. Zu den Tests gehören unter anderem Blutzucker-, Infektions- und Herzmarkertests.
Durch die schnellen Ergebnisse und die einfache Handhabung können sie die Effizienz und die Behandlungsergebnisse verbessern.
Wichtige Beispiele
-
Blutzuckermessgeräte: Zur Diabetesbehandlung.
-
Antigen-Schnelltests: Für COVID-19, Grippe und Streptokokken-Angina.
-
Urinteststreifen: Zur Urinanalyse.
-
HbA1c-Tests: Zur Blutzuckerkontrolle bei Diabetes.
-
Tragbare PCR-Testgeräte: Zum schnellen Nachweis von Infektionskrankheiten.
-
Gerinnungsanalysegeräte: Für INR/PT-Tests.
Vorteile
-
Schnellere Entscheidungen: Sofortige Ergebnisse ermöglichen eine schnellere Anpassung der Therapie.
-
Verbesserte Versorgung: Schnelles Eingreifen bei Erkrankungen wie Hypoglykämie oder Infektionen.
-
Stärkung der Patientenautonomie: Ermöglicht Patienten (z. B. Diabetikern) die Selbstkontrolle.
-
Effizienzsteigerung: Optimiert Arbeitsabläufe in Krankenhäusern, Kliniken und sogar Rettungswagen.
Einsatzgebiete
-
Krankenhäuser (Notaufnahmen, Stationen)
-
Arztpraxen/Kliniken
-
Rettungswagen
-
Gesundheitszentren
-
Patienten zu Hause (Selbsttest)
Die Nachfrage nach patientennahen Tests steigt stetig. Schnellere klinische Entscheidungsfindung, die zunehmende Belastung durch chronische Erkrankungen, technologische Fortschritte und der Trend zu dezentraleren Versorgungsmodellen tragen alle dazu bei, dass diese Geräte in der täglichen Gesundheitsversorgung immer wichtiger werden.
Wie patientennahe Tests die Versorgung verändern können
Patientennahe Tests verändern grundlegend, wie und wann klinische Entscheidungen getroffen werden. Da diagnostische Ergebnisse innerhalb von Minuten statt Stunden oder Tagen vorliegen, ermöglichen diese Tests medizinischem Fachpersonal ein sofortiges Handeln. Die Behandlung kann früher beginnen, die Behandlungswege können verkürzt und unnötige Überweisungen oder Krankenhauseinweisungen oft vermieden werden.
Dieser schnelle Zugriff auf Ergebnisse ist besonders wertvoll in zeitkritischen Situationen wie der Notfallmedizin, der Infektionsbekämpfung und der Akutversorgung. Er ist auch unerlässlich in Umgebungen, in denen der Zugang zu Laborinfrastruktur eingeschränkt ist oder in denen Patienten von einer sofortigen Diagnose im Rahmen eines einzigen Arztbesuchs profitieren.
Mit dem Wachstum des Sektors gewinnen digitale Tools zunehmend an Bedeutung, um die sichere und effektive Anwendung patientennaher Testgeräte zu unterstützen. Gebrauchsanweisungen spielen dabei eine zentrale Rolle. Klare, verständliche und aktuelle Anweisungen tragen dazu bei, die korrekte Durchführung des Tests, die genaue Interpretation der Ergebnisse und die Patientensicherheit zu gewährleisten. Elektronische Gebrauchsanweisungen können dies durch schnelle Aktualisierungen, Suchfunktionen und flexible Darstellungsformate, die sich für den Klinikalltag eignen, weiter verbessern.
Aktuelle Einschränkungen der Medizinprodukteverordnung verhindern die Verwendung elektronischer Gebrauchsanweisungen für patientennahe Testgeräte
Nach EU-Recht ist die Bereitstellung von Gebrauchsanweisungen je nach Gerätetyp unterschiedlich geregelt. Medizinprodukte fallen unter die Verordnung (EU) 2017/745 (MDR), während In-vitro-Diagnostika, einschließlich patientennaher Tests, der Verordnung (EU) 2017/746 (IVDR) unterliegen.
Die IVDR erlaubt derzeit die Bereitstellung von Gebrauchsanweisungen in elektronischer Form für alle In-vitro-Diagnostika zur professionellen Anwendung mit Ausnahme von patientennahen Testgeräten. Daher müssen Hersteller von patientennahen Tests weiterhin standardmäßig Gebrauchsanweisungen in Papierform bereitstellen, selbst wenn die Geräte ausschließlich von geschultem medizinischem Fachpersonal verwendet werden.
Im Gegensatz dazu hat sich der regulatorische Rahmen für Medizinprodukte in letzter Zeit weiterentwickelt. Die Durchführungsverordnung (EU) 2025/1234 der Kommission änderte die Durchführungsverordnung (EU) 2021/2226, um den Anwendungsbereich von Medizinprodukten, für die elektronische Gebrauchsanweisungen (eIFUs) zulässig sind, weiter auszubauen. Diese Änderung trägt der Erkenntnis Rechnung, dass elektronische Anweisungen die Zugänglichkeit, Benutzerfreundlichkeit und Nachhaltigkeit für professionelle Anwender verbessern.
Diese Erweiterung gilt jedoch nur für Medizinprodukte gemäß der MDR. Geräte für patientennahe Tests bleiben weiterhin ausgeschlossen, da sie unter die IVDR fallen, obwohl sie in sehr ähnlichen klinischen Umgebungen und von denselben Anwendergruppen eingesetzt werden. Dadurch entsteht eine regulatorische Lücke, in der zwei Kategorien von Geräten für den professionellen Gebrauch ohne klare praktische Begründung unterschiedlich behandelt werden.
Schlussfolgerungen: Aktueller Stand und Änderungsbedarf
Patientennahe Tests werden primär von medizinischem Fachpersonal oder unter dessen direkter Aufsicht durchgeführt. Diese Anwender sind geschult, digital ausgestattet und gewohnt, im Arbeitsalltag elektronisch auf Informationen zuzugreifen. Vor diesem Hintergrund erscheint die weiterhin obligatorische Bereitstellung von Papier-Gebrauchsanweisungen für Geräte für patientennahe Tests zunehmend nicht mehr zeitgemäß.
Die Zulassung elektronischer Gebrauchsanweisungen für patientennahe Tests würde eine sicherere und effizientere Anwendung fördern, da Fachkräfte stets Zugriff auf die aktuellsten validierten Anweisungen haben. Zudem würde unnötiger Papierverbrauch reduziert, die Logistik vereinfacht und der In-vitro-Diagnostiksektor mit den umfassenderen EU-Zielen zur Digitalisierung und ökologischen Nachhaltigkeit in Einklang gebracht.
Papier-Gebrauchsanweisungen sollten selbstverständlich weiterhin kostenlos für diejenigen verfügbar sein, die sie benötigen oder anfordern. Es gibt jedoch kaum eine Rechtfertigung dafür, standardmäßig Papier vorzuschreiben, wenn der elektronische Zugriff im professionellen Umfeld sowohl machbar als auch bevorzugt ist.
Eine Aktualisierung der IVDR, um elektronische Gebrauchsanweisungen für patientennahe Testgeräte zuzulassen, würde eine bestehende regulatorische Inkonsistenz beseitigen und die heutige Gesundheitsversorgung besser widerspiegeln. Dies wäre ein pragmatischer Schritt hin zu einem digitaleren, nachhaltigeren und nutzerzentrierten Rechtsrahmen für In-vitro-Diagnostika in Europa.
Referenzen
-
Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR) Verordnung des Europäischen Parlaments und des Rates zur Festlegung von Vorschriften für In-vitro-Diagnostika, einschließlich Anforderungen an Gebrauchsanweisungen und deren Format. https://eur-lex.europa.eu/eli/reg/2017/746/oj
-
Durchführungsverordnung (EU) 2025/1234 der Kommission vom 25. Juni 2025 Änderung der Durchführungsverordnung (EU) 2021/2226 hinsichtlich der Medizinprodukte, für die die Gebrauchsanweisung in elektronischer Form bereitgestellt werden darf. https://eur-lex.europa.eu/eli/reg_impl/2025/1234/oj
-
Durchführungsverordnung (EU) 2021/2226 der Kommission Vorschriften für elektronische Gebrauchsanweisungen für Medizinprodukte und In-vitro-Diagnostika, in der geänderten Fassung. https://eur-lex.europa.eu/eli/reg_impl/2021/2226/oj
-
Verordnung (EU) 2017/745 über Medizinprodukte (MDR) Verordnung des Europäischen Parlaments und des Rates über Medizinprodukte, einschließlich solcher für den professionellen Gebrauch, für die eine elektronische Gebrauchsanweisung bereitgestellt werden kann. https://eur-lex.europa.eu/eli/reg/2017/745/oj
Weitere Informationen zur eLeaflet-Lösung für Gebrauchsanweisungen und digitale Beipackzettel finden Sie auf der eLeaflet-Website.