Die EU-Generaldirektion für Gesundheit und Lebensmittelsicherheit hat einen neuen „Vorschlag für eine Verordnung zur Festlegung von Unionsverfahren für die Zulassung und Überwachung von Humanarzneimitteln und zur Festlegung von Regeln für die Europäische Arzneimittel-Agentur“ veröffentlicht, der die Verwendung der elektronischen Produktinformationen vorsieht ( im Gegensatz zu Papierbroschüren), um eine Reduzierung der Verwaltungskosten zu erreichen.

Die vollständige Fassung des Vorschlags (der den vollständigen Namen trägt: Vorschlag für eine Verordnung des Europäischen Parlaments und des Rates zur Festlegung von Unionsverfahren für die Genehmigung und Überwachung von Arzneimitteln für den menschlichen Gebrauch und zur Festlegung von Regeln für die Europäische Arzneimittel-Agentur , zur Änderung der Verordnung (EG) Nr. 1394/2007 und der Verordnung (EU) Nr. 536/2014 und zur Aufhebung der Verordnung (EG) Nr. 726/2004, der Verordnung (EG) Nr. 141/2000 und der Verordnung (EG) Nr. 1901/2006), veröffentlicht am 26. April 2023, ist verfügbar unter
Im Vorschlag gibt es mehrere Hinweise auf den Einsatz digitaler Mittel zur Beschleunigung und Verbesserung der Verfügbarkeit von Arzneimitteln auf dem EU-Markt. Zu den vorgesehenen Verbesserungen gehören:
- Elektronische Einreichungen der Industrie bei der Europäischen Arzneimittel-Agentur und den zuständigen Behörden der Mitgliedstaaten werden der Industrie Kosteneinsparungen bescheren
- Die Verwendung elektronischer Produktinformationen (im Gegensatz zu Papierbroschüren) sollte auch zu einer Reduzierung der Verwaltungskosten führen
- um die Leistung der Pharmakovigilanz-Aktivitäten zu harmonisieren ... Maßnahmen umzusetzen, die ... das Format und den Inhalt der elektronischen Übermittlung vermuteter Nebenwirkungen durch Mitgliedstaaten und Inhaber von Genehmigungen für das Inverkehrbringen umfassen.
Die Botschaft zum Mitnehmen: Die EU arbeitet an neuen Rechtsvorschriften, um die Zulassung, den Vertrieb und die Überwachung von Arzneimitteln innerhalb der EU zu harmonisieren. Die Umsetzung und Regulierung digitaler Lösungen ist ein wesentlicher Bestandteil dieses neuen Vorschlags.
Die eLeaflet-Lösung von myHealthbox unterstützt bereits die meisten ePI-Anforderungen, einschließlich der Erfassung und Verwaltung digitaler Formulare für unerwünschte Reaktionen. Um mehr über diese Lösung zu erfahren, ist dies ein guter Ausgangspunkt eLeaflet home page.
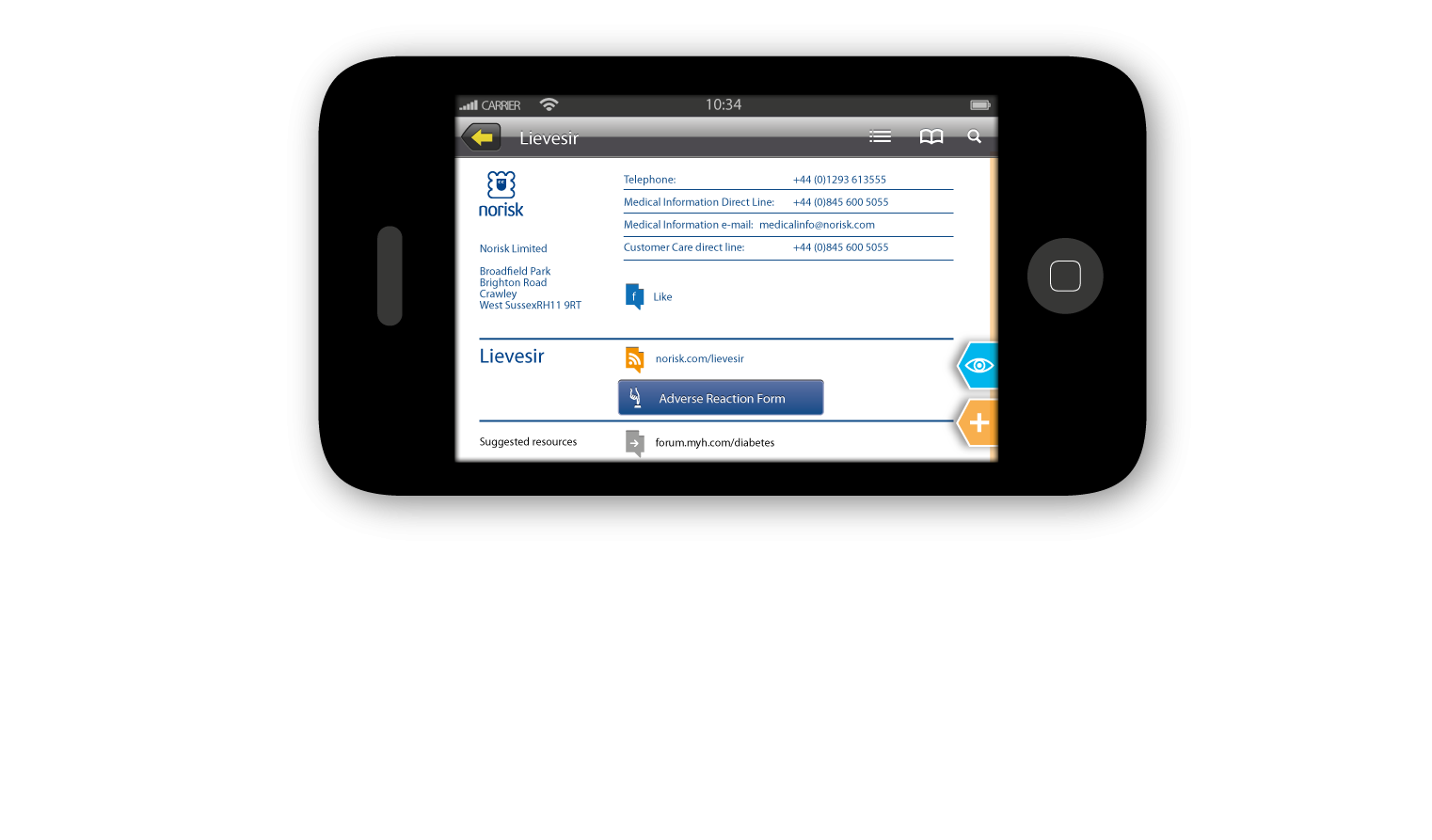
Bei Fragen wenden Sie sich bitte an unseren Kundenservice unter info@myhealthbox.eu